六氟化鎝
六氟化鎝是一個低熔點的金黃色無機化合物[1],其化學式為TcF6,發現於1961年[3]。在這化合物中,鎝有+6價,是目前發現的鎝化合物中,氧化價最高的2個鹵化物之一,另一個是六氯化鎝(Technetium(VI) chloride, TcCl6)。其中,這裡的鎝與形成七氟化錸(ReF7)的錸不同[4]。六氟化鎝會出現在六氟化鈾的雜質中,因為鎝是鈾的裂變產物。
| 六氟化鎝 | |
|---|---|
 | |
| IUPAC名 Technetium(VI) fluoride | |
| 识别 | |
| CAS号 | 13842-93-8 |
| PubChem | 57470148 |
| SMILES |
|
| InChIKey | PRVOBRCYHYXCMU-UHFFFAOYSA-H |
| 性质 | |
| 化学式 | TcF6 |
| 摩尔质量 | 212 g/mol (98Tc) g·mol⁻¹ |
| 外观 | 金黃色晶體[1] |
| 密度 | 3,58 g/cm3 (−140 °C、固態)[2] |
| 熔点 | 37.4 °C(311 K) |
| 沸点 | 55.3 °C(328 K) |
| 结构 | |
| 晶体结构 | 立方晶系 |
| 危险性 | |
| 欧盟分类 | 不在名單中 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
特徵
六氟化鎝在室溫下為金黃色固體。其熔點较低,約為37.4℃[1],當環境溫度高於38℃就會熔化,沸點為55.3℃[1],其在標準狀態下液相的範圍不大,僅有17.9℃。
六氟化鎝在−4.54 °C會發生一次相變,高於該溫度時,晶體結構為立方晶系,其晶格常數 a 為 6.16 Å[註 1]。每單位晶格有兩個配方單位[註 2],其密度為3.02 g·cm−3;而低於該溫度時,晶體結構為正交晶系,其晶格常數a 為 9.55 Å、b 為 8.74 Å,、c 為 5.02 Å[註 3]。每單位晶格有四個配方單位[註 2],其密度為3.38 g·cm−3。而當溫度降到了攝氏−140℃時,晶格雖然保持為正交晶系,但晶格常數改變了,a 變為 9.360 Å、b 變為 8.517 Å而c 則變為 4.934 Å,密度也改變了,變為3.58 g·cm−3。[2]
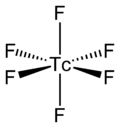
而TcF6的分子本身[註 4]的分子結構為八面体形分子构型,點群為八面體對稱(Oh)、Tc-F鍵的鍵長為1.812Å[2]、其磁矩測量值為0.45 μB[5]。
性質
由於鎝沒有穩定的同位素,因此六氟化鎝通常具放射性,常溫下為黃色固體,
註解
- 於攝氏10度測量
- 在這種情況下是離散分子
- 於攝氏-19度測量
- 這種形式(單一分子)對於液相或氣相重要
參考文獻
- CRC Handbook of Chemistry and Physics, 90th Edition, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0, Section 4, Physical Constants of Inorganic Compounds, p. 4-93.
- Drews, T.; Supeł, J.; Hagenbach, A.; Seppelt, K. . Inorganic Chemistry. 2006, 45 (9): 3782–3788. PMID 16634614. doi:10.1021/ic052029f.
- Selig, H.; Chernick, C.L.; Malm, J.G. . Journal of Inorganic and Nuclear Chemistry. 1961, 19 (3–4): 377–381.
- Greenwood, N. N.; Earnshaw, A. 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- Selig, H.; Cafasso, F. A.; Gruen, D. M.; Malm, J. G. . Journal of Chemical Physics. 1962, 36 (12): 3440. Bibcode:1962JChPh..36.3440S. doi:10.1063/1.1732477.
- Howard H. Claassen; Henry Selig & John G. Malm. . Journal of Chemical Physics. 1962, 36 (11): 2888–2890. Bibcode:1962JChPh..36.2888C. doi:10.1063/1.1732396.
- Howard H. Claassen; Gordon L. Goodman; John H. Holloway & Henry Selig. . Journal of Chemical Physics. 1970, 53 (1): 341–348. Bibcode:1970JChPh..53..341C. doi:10.1063/1.1673786.
- Siegel S & Northrop DA. . Inorganic Chemistry. 1966, 5 (12): 2187–2188. doi:10.1021/ic50046a025.
- Selig, H; Cafasso, F A.; Gruen, D M.; Malm, J G. . Journal of Chemical Physics. 1962, 36 (12): 3440–3444. Bibcode:1962JChPh..36.3440S. doi:10.1063/1.1732477.
- Edwards, A. J.; Hugill, D.; Peacock, R. D. . Nature. 1963, 200 (4907): 672. Bibcode:1963Natur.200..672E. doi:10.1038/200672a0.
- D. Hugill & R. D. Peacock. . Journal of the Chemical Society A. 1966: 1339–1341. doi:10.1039/J19660001339.
- Frlec B; Selig H & Hyman H.H. . Inorganic Chemistry. 1967, 6 (10): 1775–1783. doi:10.1021/ic50056a004.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.