RNA剪接
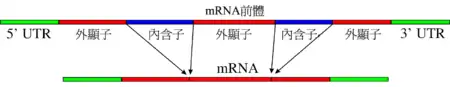
剪接(英語:,又稱拼接),是一种基因重组現象,在分子生物學中,主要是指細胞核內基因資訊在轉錄過程中或是在轉錄過後的一种修飾,即將內含子移除及合併外顯子——內含子與外顯子的名稱是通用於編碼基因的DNA及其轉錄後的RNA——是真核生物的前mRNA變成mRNA的過程之一。剪接過程是剪接體內核糖核酸(RNA)核苷酸之間的一連串生化反應,並由剪接體內小核核糖蛋白(snRNP)中的snRNA負責催化並作用。此外,也有一些類型不需外在催化物質,而是在特定二價金屬離子存在的情況下,以RNA自我催化的方式進行剪接,如第一型或第二型內含子 (group-I or group-II intron)或核酸酶(ribozyme)。這也是真核生物與原核生物的区别之一(请参看顺反子)。成熟的mRNA會接著進行蛋白質生物合成中的翻譯,以產生蛋白質,稱轉譯作用。
剪接途徑
RNA剪接可以有多種的方式。剪接的型式以內含子的結構及剪接所需的剪接因子而定。此外,RNA剪接還分為分子內 (intramolecular) 剪接 (cis splicing) 以及分子間 (intermolecular) 剪接 (trans splicing)。
剪接體
內含子經常存在於真核生物的蛋白質編碼基因(coding gene)中,也存在於rRNA、tRNA以及許多病毒的基因組內。在內含子裡,需要有 5' 剪接位點(5' splice site)、3' 剪接位點(3' splice site)及剪接分枝位點(branch point)來進行剪接。剪接是由剪接體(Spliceosome)來催化,它是以五個不同的小核核糖核酸 (snRNAs) 以及不下於一百個蛋白質所組成的大型核糖核酸蛋白質複合物,稱為小核核糖蛋白(snRNP)所組成。小核核糖蛋白的 RNA 會與內含子行雜交作用(hybridization),並且參與剪接的催化反應。
自剪接
自剪接出現在稀少的內含子組成核酸酶,核酸酶在只有RNA的情況下代替了剪接體的功能。自剪接的內含子有三種,稱為第一型、第二型及第三型。自剪接型內含子以與剪接體類似的方式進行剪接,但不需要任何蛋白質。這種相似性使人相信這些內含子與剪接體在演化過程上有著關連。自剪接亦可能是非常古老,且可能出現在一個還未有蛋白質的核糖核酸世界。雖然以下兩種剪接可以在沒有蛋白質的情況下進行,但依然會額外的使用5個RNA分子(snoRNAs)及超過50多個蛋白質,並水解多個三磷酸腺苷(ATP)分子。使用 ATP 是要提高剪接mRNA的準確性,避免出現錯誤。
以下兩次轉酯化是第一型內含子自剪接的特徵:
- 游離鳥嘌呤核苷酸(被包在內含子中)的3'羥基,或是核苷酸輔助因子(即鳥苷单磷酸(GMP)、鳥苷二磷酸(GDP)、鳥苷三磷酸(GTP))攻擊內含子的5'剪接位點。內含子並不形成套索結構,而該鳥糞苷則會從內含子中轉移位置到內含子的5'位,從而成為第I型內含子的第一個核苷酸。
- 內含子5'剪接位點上游外顯子最後一個核苷酸的3'羥基變成親核基,而第二次交酯化/轉酯化會將兩個外顯子接合。
以下是第二型內含子自剪接的特徵(與第I型相同是兩次交酯化):
- 內含子內特定腺苷的2'羥基攻擊5'剪接位點,從而形成一個套索。
- 5'外顯子的3'羥基新親核基於3'剪接位點引發第二次的交酯化/轉酯化反應,從而將兩個外顯子接合。
第三型內含子的自剪接過程則類似第二型內含子。以下為其他特徵:
- 第三型內含子的長度普遍小於第一型或第二型內含子(約為 95–110 個核苷酸長)。
- 没有第二型內含子般的保留式二級結構,但在自前接過程中同樣會形成套索。
- 常存於葉緣體中與轉錄和轉譯有關的基因內。
- 序列中的 A/T 含量相對較高。
演化
在所有生物界或生物域中都有出現剪接,剪接的幅度及類型在主要的生物門中都可以非常不同。真核生物中RNA剪接好發於mRNA及一些非編碼RNA。原核生物則很少剪接,但多是非編碼RNA。兩種生物最大的差異是原核生物沒有剪接體剪接途徑。
| 真核生物 | 原核生物 | |
|---|---|---|
| 剪接體 | + | - |
| 自剪接 | + | + |
| tRNA | + | + |
由於剪接體內含子並非在所有 生物種中得到保存,有人便因此質疑剪接體演化的起始點。現時有兩種建議的模式:內含子先天存在理論及內含子後天衍生理論。
生物化學過程

剪接體剪接及自剪接涉及兩個步驟的生物化學過程。兩個步驟均需要在RNA間進行轉酯化反應。但是tRNA剪接則沒有交醋化/轉酯化過程。
剪接體及自剪接交酯化反應的發生有特定的次序。首先,一個在內含子的特定「剪接分枝位點」核苷酸會與這個內含子的第一個核苷酸產生轉酯化反應,形成兩個RNA分子,一個是「內含子套索」另一個則是內含子前的外顯子。第二,第一個外顯子最後的核苷酸會與第二個外顯子的首個核苷酸產生轉酯化反應,連接外顯子並釋放內含子套索。 而在真核生物中,需要多種的snRNP合作,其中包括U1.U2.U4.U5.U6snRNA的輔助.其中詳細的機制為:
1.U1snRNA與靠近第一外顯子(5'外顯子)的內含子區段結合,U2會接合上轉接點並且使其上的一個腺嘌呤突出. 2.接著,U6,U4複合體會準備接上,同時間U5snRNA會被U2AF蛋白徵召,而U2AF會被第2外顯子的ESE上的SR蛋白吸引. 3.U6的其中一段會將U1置換並且與U2的一段結合,而在此時,這條pre_mRNA已經被彎曲,並且U4會離開.因此有理論推斷U4和U1是有抑制U6活性的功能. 4.轉接點的腺嘌呤會對外顯子一座親核性攻擊產生少見的2'-5'磷酸雙酯鍵,並且產生一個內含子套索,這是第一反應 5.最後,在U5的輔助下,會對內含子套索的接點做第二次攻擊,並且使內含子套索脫落,使第一和第二外顯子結合,完成修飾
選擇性剪接
在很多時候,剪接過程可以透過對同一個基因轉錄的相同pre-mRNA使用不同的剪接選擇,產生不同的mRNA異構物(isoform),最後產生多種相似卻又獨特的蛋白質,或是產生出穩定性低的mRNA產物以達到調節基因表現的目的。而由於選擇性剪接的存在而使基因組可以產生比基因數量還多許多倍的基因產物。例如抗體的製造。
Pre-mRNA的剪接也並不是完美的。據估計,人體細胞中有約70%的基因會進行選擇性剪接。而其中又有三分之二以上的剪接產物 (spliced transcripts) 因為剪接過程的不夠精確、或是形成未成熟的終止密碼子 (premature termination codon, PTC) 而造成該 RNA 的降解 (RNA degradation)[1]。另有研究顯示,剪接過程中的交酯化/轉酯化反應在特定條件下是可逆的[2]。這對於剪接反應如何維持或調結其精確性提供了新的思路,並對如何治療因剪接錯誤而起的人類疾病提供了新方向。
剪接的實驗處理
干擾 mRNA 剪接的實驗可以透過將以嗎啉基或肽核酸修飾之反義寡核苷酸結合在 snRNP 於 mRNA 上的結合位點、型成套索結的核苷酸分支點或剪接調控因子的結合位點上[3]來作出修改。[4][5]
另外,藉由影響剪接調控因子在細胞的正常表現,或是在試管反應中控制調控因子的相對濃度,甚至是剪接體的相對濃度都能達成對 mRNA 剪接干擾的目的。
剪接誤差
參考
- Sorek R, Shamir R, Ast G. . Trends Genet. 2004, 20 (2): 68–71. PMID 14746986.
- Tseng CK, Cheng SC. . Science. 2008, 320 (5884): 2409–20. PMID 18583613.
- Bruno IG, Jin W, Cote GJ. . Hum Mol Genet. 2004, 13 (20): 2409–20. PMID 15333583.
- Draper BW, Morcos PA, Kimmel CB. . Genesis. 2001, 30 (3): 154–6. PMID 11477696.
- Sazani P, Kang SH, Maier MA, Wei C, Dillman J, Summerton J, Manoharan M, Kole R. . Nucleic Acids Res. 2001, 29 (19): 3965–74. PMID 11574678.