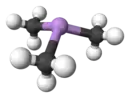
三甲基胂
三甲基胂(英語:,简称TMA)是一种分子式为(CH3)3As(常缩写为AsMe3)的有机砷化合物。它是胂的衍生物,且是最简单的三烷基胂,具有类似大蒜的气味。早在1854年人们已经发现了这种化合物。
| 三甲基胂 | |||
|---|---|---|---|
| |||
| 系统名 Trimethylarsane | |||
| 别名 | 三甲基砷、三甲胂、Gosio gas | ||
| 识别 | |||
| CAS号 | 593-88-4 | ||
| PubChem | 68978 | ||
| ChemSpider | 62200 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | HTDIUWINAKAPER-UHFFFAOYAT | ||
| Beilstein | 1730780 | ||
| Gmelin | 141657 | ||
| EINECS | 209-815-8 | ||
| ChEBI | 27130 | ||
| RTECS | CH8800000 | ||
| MeSH | Trimethylarsine | ||
| 性质 | |||
| 化学式 | C3H9As | ||
| 摩尔质量 | 120.03 g·mol−1 | ||
| 精确质量 | 119.992021705 g·mol-1 | ||
| 外观 | 无色液体 | ||
| 密度 | 1.124 g cm-3 | ||
| 熔点 | -87.3 °C(186 K) | ||
| 沸点 | 51 °C(324 K) | ||
| 溶解性(水) | 微溶 | ||
| 溶解性(有机溶剂) | 可溶 | ||
| 结构 | |||
| 配位几何 | 三方锥 | ||
| 偶极矩 | 0.86 D | ||
| 危险性 | |||
| 警示术语 | R:R23/25 R50/53 | ||
| 安全术语 | S:S1/2 S20/21 S28 S45 S60 S61 | ||
| MSDS | External MSDS | ||
| 主要危害 | 可燃 | ||
| 闪点 | 100 °C | ||
| 相关物质 | |||
| 相关化学品 | 二甲胂酸 三苯基胂 | ||
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |||
结构与合成
根据价层电子对互斥理论,三甲基胂的分子结构为三角锥形。分子中的As-C键平均长度为1.519 Å,C-As-C键角为91.83°。[1] 这个键角是一个强烈的迹象,表明了三甲基胂分子中的原子轨道如同胂一样,没有或仅有极弱的杂化,因此砷原子s轨道上的孤对电子嵌在3s轨道中,而不是像三甲胺的孤对电子一样由于sp3杂化而裸露在外。
- As2O3 + 1.5 [AlMe3]2 → 2 AsMe3 + 3/n (MeAl-O)n
用途与重要性
三甲基胂在微电子学中被用作砷元素的来源之一。[7] 在化学上它则被用于制取其他有机砷化合物,及作为配位化学研究中的配体。
土壤和岩石中的一些微生物能够作用于无机砷元素,并向大气中释放副产物三甲基胂。[8] 极少量的(ppm级)三甲基胂曾被发现于德国、加拿大和美国一些地方的填埋气中,并且是其中最主要含砷化合物。[9][10][11]
毒性
在19世纪及20世纪初,人们曾认为一些室内中毒事件是由微生物产生的一种与颜料中的砷元素有关的气体导致的。1893年,意大利医生巴托罗密欧·高西欧发表了他的一份研究报告,将它认为引起中毒的气体命名为“Gosio gas”,这种气体后来被证明含有三甲基胂。[12] 事实上,在潮湿的环境下,霉菌短帚霉通过含砷颜料(特别是曾用于室内墙纸上色的巴黎绿和许雷绿)的甲基化的确能够产生大量的三甲基胂。[13] 不过,后来的研究显示三甲基胂的毒性很小,因此不可能是导致19世纪时是几起严重中毒及死亡事件的化学物质。[6][14]
参考资料
- Wells, A.F. . Oxford University Press. 1984. ISBN 0-19-855370-6.
- V. V. Gavrilenko, L. A. Chekulaeva, and I. V. Pisareva, "Highly efficient synthesis of trimethylarsine" Izvestiya Akademii Nauk. Seriya Khimicheskaya, No. 8, pp. 2122–2123, 1996.
- Andrewes, Paul; 等. . Chem. Res. Toxicol. 2003, 16 (8): 994–1003.
- Irvin, T.Rick; 等. . Applied Organometallic Chemistry. 1995, 9: 315–321.
- Hiroshi Yamauchi, Toshikazu Kaise, Keiko Takahashi, Yukio Yamamura. . Fundamental and Applied Toxicology. 1990, 14 (2): 399–407. PMID 2318361. doi:10.1016/0272-0590(90)90219-A.
- William R. Cullen, Ronald Bentley. . J. Environ. Monit. 2005, 7 (1): 11–15. PMID 15693178. doi:10.1039/b413752n.
- Hoshino, Masataka. . Journal of Crystal Growth. 1991, 110 (4): 704–712. doi:10.1016/0022-0248(91)90627-H.
- Cullen, W.R., Reimer, K.J. . Chem. Reviews. 1989, 89 (4): 713–764,. doi:10.1021/cr00094a002.
- Feldmann, J., Cullen, W.R. . Environ. Sci. Technol. 1997, 31 (7): 2125–2129. doi:10.1021/es960952y.
- Pinel-Raffaitin, P., LeHecho, I., Amouroux, D., Potin-Gautier, M. . Environ. Sci. Technol. 2007, 41 (13): 4536–4541. PMID 17695893. doi:10.1021/es0628506.
- Khoury, J.T.; 等. . . Phoenix, Arizona: Water Environment Federation. April 7, 2008.
- Frederick Challenger. . Q. Rev. Chem. Soc. 1955, 9 (3): 255–286. doi:10.1039/QR9550900255.
- Ronald Bentley and Thomas G. Chasteen. . Microbiology and Molecular Biology Reviews. 2002, 66 (2): 250–271. PMC 120786. PMID 12040126. doi:10.1128/MMBR.66.2.250-271.2002.
- Frederick Challenger, Constance Higginbottom, Louis Ellis. . J. Chem. Soc. 1933: 95–101. doi:10.1039/JR9330000095.
外部链接(英文)
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.