催化剂
催化劑又稱觸媒,是能通過提供另一活化能較低的反應途徑而加快化學反應速率,而本身的質量、組成和化學性質在參加化學反應前後保持不變的物質。[1]例如二氧化錳可以作為過氧化氫(雙氧水)分解的催化劑。[2]與催化劑相反,能減慢反應速率的物質稱為抑制劑。過去曾用的「負催化劑」一詞已不被國際純粹與應用化學聯合會所接受,而必須改用抑制劑一詞,催化劑一詞僅指能加快反應速率的物質。[3]

催化劑與反應
催化劑與反應誘導化學反應發生改變,而使化學反應變快或者在較低的溫度環境下進行化學反應。
催化剂加速反应过程一般具有两个途径,一个是增加反应物的活性中心,另一种是改变反应途径。
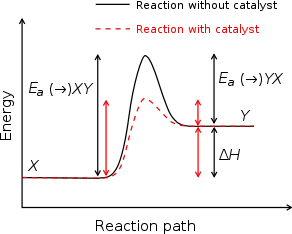
我們可在波茲曼分布(Boltzmann distribution)與能量關係圖(energy profile diagram)中觀察到,催化劑可使化學反應物在不改變的情形下,經由只需較少活化能(activation energy)的路徑來進行化學反應。而通常在這種能量下,分子不是無法完成化學反應,不然就是需要較長時間來完成化學反應。但在有催化劑的環境下,分子只需較少的能量即可完成化學反應。
催化劑的種類



催化劑分均相催化劑與非均相催化劑。非均相催化劑呈現在不同相(Phase)的反應中(如:固態催化劑在液態混合反應和固態催化劑在氣態混合反應等),而均相催化劑則是呈現在同一相的反應(例如:液態催化劑在液態混合反應)。一個簡易的非均相催化反應包含了反應物(或)吸附在催化劑的表面,反應物內的鍵因十分的脆弱而導致新的鍵產生,但又因產物與催化劑間的鍵並不牢固,而使產物出現。目前已知許多表反應發生吸附反應的不同可能性的結構位置。一般生活中較常用非均相催化劑,利用不同狀態的特性較好分離出產物與催化物(如汽機車排氣管中的觸媒)。
负催化剂(抑制剂)
教科书(人教版)
负催化剂(抑制剂)按照IUPAC的标准而言应当独立于催化剂之外,但是根据全国科学技术名词审定委员会公布的《化学名词(第二版)》(2016),催化剂的定义为改变反应速率但不改变反应总吉布斯自由能的物质。我国教科书中使用的定义大多参照此来源。
初中教科书对催化剂给出了便于中学生理解的描述性的定义[4],而该定义则根据《化学名词(第二版)》将抑制剂包含于催化剂定义之中。
国际纯粹与应用化学联合会(IUPAC)
催化剂指一种提高反应速率而不改变总体标准反应中吉布斯能量变化的物质,而使用催化剂参与反应的过程称为催化。催化剂既是反应物又是反应产物。当添加的物质降低反应速率时,不应使用催化剂和催化一词(参见抑制剂)。
常见的催化反应
氯酸钾制取氧气
二氧化锰制取氧气
参考资料
- John C. Kotz, Paul M. Treichel, John Townsend. . Cengage Learning. 2011: P.695 – 697. ISBN 978-0840048288.
- 课程教材研究所; 化学课程教材研究开发中心.人民教育出版社. . 北京: 人民教育出版社. 2012.2013. ISBN 9787107245015. p40
- IUPAC Gold Book. . IUPAC. [2014-02-26]. (原始内容存档于2016-12-24).
- . 北京: 人民教育出版社. 2012年6月第1版: 39. ISBN 9787107245015.
在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫做催化剂(又叫触媒)
Authors list列表中的|first1=缺少|last1=(帮助);