四氟化硫
四氟化硫,化學式為SF4。在標準環境下為無色具腐蝕性以及劇毒氣體,接觸水或潮濕環境會造成危險。儘管如此,四氟化硫仍用於有機合成,是製作碳氟化合物的常用試劑。[2]
| 四氟化硫 | |||
|---|---|---|---|
 | |||
| |||
| IUPAC名 Sulfur(IV) fluoride | |||
| 识别 | |||
| CAS号 | 7783-60-0 | ||
| PubChem | 24555 | ||
| ChemSpider | 22961 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | QHMQWEPBXSHHLH-UHFFFAOYAT | ||
| UN编号 | 2418 | ||
| ChEBI | 30495 | ||
| RTECS | WT4800000 | ||
| 性质 | |||
| 化学式 | SF4 | ||
| 摩尔质量 | 108.07 g/mol g·mol⁻¹ | ||
| 外观 | 無色氣體 | ||
| 密度 | 1.95 g/cm3, −78 °C | ||
| 熔点 | −121.0 °C | ||
| 沸点 | −38 °C | ||
| 溶解性(水) | 分解 | ||
| 结构 | |||
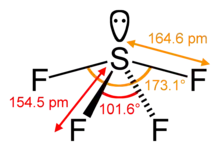
| 分子构型 | 蹺蹺板型 | ||
| 偶极矩 | 0.632 德拜[1] | ||
| 危险性 | |||
| MSDS | ICSC 1456 | ||
| 欧盟编号 | 未列出 | ||
| 主要危害 | 有毒 腐蝕性 | ||
| NFPA 704 |
 0
3
2
COR
| ||
| 相关物质 | |||
| 其他阴离子 | 二氯化硫 二溴化二硫 三氟化硫 | ||
| 其他阳离子 | 二氟化氧 四氟化硒 四氟化碲 四氟化釙 | ||
| 相关化合物 | 二氟化二硫 二氟化硫 六氟化硫 | ||
| 相关化学品 | 亞硫酰氟 | ||
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |||
- SF4 + 2 H2O → SO2 + 4 HF
外部連結
- Tolles, W. M.; W. M. Gwinn, W. D. . J. Chem. Phys. 1962, 36: 1119–1121. doi:10.1063/1.1732702.
- C.-L. J. Wang, "Sulfur Tetrafluoride" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi:10.1002/047084289.
- Greenwood, Norman N.; Earnshaw, Alan., 2nd, Oxford: Butterworth-Heinemann, 1997, ISBN 0080379419
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.


