拉乌尔定律
拉烏爾定律(英語:)描述了溶液的蒸氣壓與其濃度的關係,由法國物理家弗朗索瓦·马里-拉乌尔於1887年根據試驗結果得到。它指出一定温度下,理想溶液内每一組分的蒸氣壓等於该組分的摩尔分数與其作純溶劑時的蒸气压的乘積,且總的蒸氣壓等於各組分的蒸氣壓之和。
其數學表示爲:
每個組分的蒸氣壓:
其中為溶液的蒸氣壓,為組分作純溶劑時的蒸氣壓,為溶劑的摩尔分数。
拉烏爾定律亦可以蒸氣壓下降表述爲:「理想溶液在一定溫度下的蒸氣壓下降與溶質的摩爾分數成正比。」
此時其數學表示爲:
其中爲溶液的蒸氣壓下降,爲純溶劑的飽和蒸氣壓,爲溶質的摩尔分数。
若用質量摩爾濃度代替摩爾分數,可作如下近似處理:
其中爲溶質的質量摩爾分數,一般稱爲蒸氣壓下降常數。
需要注意的是,拉烏爾定律僅適用於理想溶液,應用於難揮發的非電解質稀溶液時所得結果是近似的。不過若溶質與溶劑皆具有揮發性且不發生相互作用時,其仍可視作理想溶液,拉烏爾定律仍然適用,溶液的總蒸氣壓等於溶質與溶劑的蒸氣壓之和。
實際溶液中的情況
實際溶液並不完全遵守拉烏爾定律,這是由溶液中不同組分之間相互作用力的不同所導致(亨利定律)。
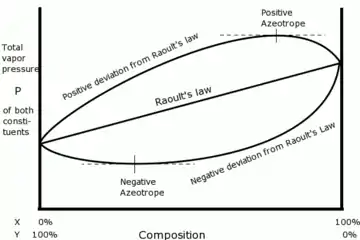
不同溶液的蒸氣壓曲線以及正、負共沸物所對應的最大和最小值。
參考資料
- 北京、華中、南京師範大學無機化學研究室. . 北京: 高等教育出版社. 2002年8月: 300-301 [2013-07-21]. ISBN 978-7-04-010768-5 (中文(中国大陆)).
- K. Kwak, D.E. Rosenfeld, J.K. Chung and M.D. Fayer. . 2008: 112,13906–13915.
- P. Atkins and J. de Paula. . W.H. Freeman. 2006: 146,184.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
