氧的氟化物
氧的氟化物是一类只由氧和氟组成的化合物,通式 OnF2, n = 1 至 6。一共有七种氧的氟化物被发现:
- 二氟化氧 (OF2)
- 二氟化二氧 (O2F2)
- 二氟化三氧,又称二氟化臭氧(O3F2)[1][2]
- 二氟化四氧(O4F2)[3]
- 二氟化五氧(O5F2)
- 二氟化六氧 (O6F2)[4]
- 一氟化二氧自由基(O2F)
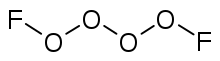
二氟化四氧
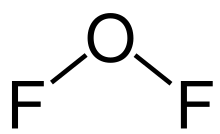
二氟化氧
氧的氟化物是具有高能量的强氧化剂,可以瞬时或以受控的速率释放其能量。因此,这些化合物作为喷气推进系统中的潜在燃料备受关注。[5]
性质
这里有三种最常见的氧的氟化物 – 二氟化氧 (OF2), 二氟化二氧(O2F2) 和二氟化三氧(O3F2)的性质。
二氟化氧(OF2)
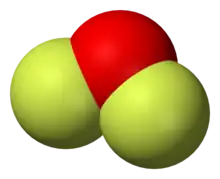
二氟化氧
二氟化氧的一般制备方法是用氟单质氟化氢氧化钠而成:
OF2 是一种无色气体,在128 K以下是一种黄色液体。它有一种不愉快的恶臭,并且有毒。[3] 它可以和氢卤酸反应,生成相应的卤素单质:
它也可以替代卤化物里的卤素离子,生成氟化物。[3] 它是一种高效的氟化剂和强氧化剂。当和不饱和的氮的氟化物(例如:四氟肼)放电时,会产生三氟化氮和氮氧化物。[6][7]
参考资料
- Solomon, I. J. 等. . Journal of the American Chemical Society. 1968, 90 (20): 5408–5411. doi:10.1021/ja01022a014.
- Misochko, Eugenii Ya, Alexander V. Akimov, Charles A. Wight. . The Journal of Physical Chemistry A. 1999, 103 (40): 7972–7977. Bibcode:1999JPCA..103.7972M. doi:10.1021/jp9921194.
- Streng, A. G. . Chemical Reviews. 1963, 63 (6): 607–624. doi:10.1021/cr60226a003.
- Streng, A. G., A. V. Grosse. . Journal of the American Chemical Society. 1966, 88: 169–170. doi:10.1021/ja00953a035.
- Jäger, Susanne 等. . . Berlin, Heidelberg: Springer. 1986: 1–161.
- Nikitin, Igor Vasil'evich, and V. Ya Rosolovskii. . Russian Chemical Reviews. 1971, 40 (11): 889–900. Bibcode:1971RuCRv..40..889N. doi:10.1070/rc1971v040n11abeh001981.
- Lawless, Edward W., Ivan C. Smith. . M. Dekker. 1968.
- Marx, Rupert, Konrad Seppelt. . Dalton Transactions. 2015, 44 (45): 19659–19662. PMID 26351980. doi:10.1039/c5dt02247a.
- Solomon, Irvine J. Research on Chemistry of and . No. IITRI-C227-6. IIT RESEARCH INST CHICAGO IL, 1964.
- Goetschel, Charles T. 等. . Journal of the American Chemical Society. 1969, 91 (17): 4702–4707. doi:10.1021/ja01045a020.
- De Marco, Ronald A., and Jean'ne M. Shreeve . "Fluorinated Peroxides." Advances in Inorganic Chemistry and Radiochemistry. Vol. 16. Academic Press, 1974. 109-176.
参见
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.