氮化鋰
氮化鋰是由氮和鋰組成的化合物,化學式為Li3N。氮化鋰是鹼金屬氮化物中熱穩定性最高的化合物,也是當中唯一一個可以在室溫下製備的化合物[1]。氮化物熔點很高,常溫下為紫色或紅色的晶状固體。
| 氮化鋰 | |
|---|---|
 | |
| IUPAC名 Lithium nitride | |
| 识别 | |
| CAS号 | 26134-62-3 |
| PubChem | 520242 |
| SMILES |
|
| InChI |
|
| InChIKey | AJUFTLIHDBAQOK-UHFFFAOYSA-N |
| EINECS | 247-475-2 |
| ChEBI | 30525 |
| 性质 | |
| 化学式 | Li3N |
| 摩尔质量 | 34.83 g·mol⁻¹ |
| 外观 | 紅色或紫色的固體 |
| 密度 | 1.270 g/cm3 |
| 熔点 | 813 °C(1086 K) |
| 溶解性(水) | 會和水反應 |
| log P | 3.24 |
| 危险性 | |
| 主要危害 | 和水反應後會產生氨 |
| 相关物质 | |
| 其他阴离子 | 氧化鋰 |
| 其他阳离子 | 氮化鈉 |
| 相关化学品 | 氨基鋰 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
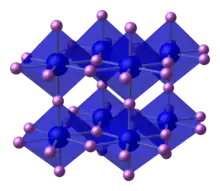
结构
氮化鋰的晶體構造相當特殊,可分為二層:其中一層為 Li2N−,其中的锂原子为六配位;而另一層只有鋰離子。氮化鋰是一種快離子導體(fast ion conductor)且其電導率比其他無機的鋰鹽都高。目前已有許多研究是針對氮化鋰作為電池固體電極及陰極材枓的應用。[2]
性质
- Li3N (s) + 3 H2O (l) → 3 LiOH (aq) + NH3 (g)
其他鹼金屬及鹼土金屬的氮化物由於其強鹼性,和水也會有類似的反應。
细粉状的氮化锂可在空气中起火燃烧,因此氮化锂必须在惰性气体中储存和处理。氮化鋰是超強鹼,其鹼性比負氫離子還要強,因此可以將氫去質子化:
- Li3N (s) + 2 H2 (g) → LiNH2 (s) + 2 LiH (s)
參考資料
- WebElements 页面存档备份,存于
- Greenwood, N. N.; Earnshaw, A. 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- Kumar De, Anil. . New Age International. 203. ISBN 8122413846.
- US patent 4888258 (1989)
- Barker M.G., Blake A.J, Edwards P.P., Gregory D.H., Hamor T. A., Siddons D. J., Smith S. E. . Chem. Commun. 1999: 1187–1188. doi:10.1039/a902962a.
- Ping Chen, Zhitao Xiong, Jizhong Luo, Jianyi Lin and Kuang Lee Tan. . Nature. 2002, 420: 302–304. doi:10.1038/nature01210.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.