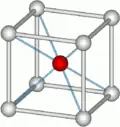
氯化铯
| 氯化铯 | |
|---|---|
 | |
 | |
| 识别 | |
| CAS号 | 7647-17-8 |
| PubChem | 24943 |
| ChemSpider | 22713 |
| SMILES |
|
| InChI |
|
| InChIKey | AIYUHDOJVYHWHXWOFAO |
| EINECS | 231-600-2 |
| 性质 | |
| 化学式 | CsCl |
| 摩尔质量 | 168.36 g·mol⁻¹ |
| 外观 | 白色固体 |
| 密度 | (固)3.99 |
| 熔点 | 645 °C |
| 沸点 | 1295 °C |
| 溶解性(水) | 162 g/100 ml (1 °C) |
| 结构 | |
| 配位几何 | 简单立方 |
| 相关物质 | |
| 其他阴离子 | 氟化铯 溴化铯 碘化铯 |
| 其他阳离子 | 氯化钾 氯化铷 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
氯化铯是一种无机盐,分子式为CsCl。氯化铯型结构是一种很重要的晶体结构。
物理性质
| Т (°C) | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| S (重量%) | 61.83 | 63.48 | 64.96 | 65.64 | 66.29 | 67.50 | 68.60 | 69.61 | 70.54 | 71.40 | 72.21 | 72.96 |
化学性质
氯化銫的水溶液呈中性。 由氯化铯制备硫酸铯时,在浓硫酸或硫酸氢铯加热,温度为550-700℃:
- 2 CsCl + H2SO4 → Cs2SO4+ HCl
- CsCl + CsHSO4 → Cs2SO4 + HCl
氯化铯可与其他多种氯化物形成复盐。例子包括2CsCl·BaCl2,2CsCl·CuCl2, CsCl·2CuCl和CsCl·LiCl等。 或与卤素互化物反应:
- CsCl + ICl3 → Cs[ICl4]
工业制法
在工业上,氯化铯可用铯榴石制备: 在加热条件下,用盐酸处理,得到氯化铯。 之后用三氯化锑、氯化碘或氯化铈(IV)精制,得到难溶的复盐,后用硫化氢处理。
- CsCl + SbCl3 → CsSbCl4
- 2 CsSbCl4 + 3 H2S → 2 CsCl + Sb2S3 + 8 HCl
重结晶后的Cs[ICl2](或Cs[ICl4])通过热分解,也可制备高纯度的氯化铯。
- Cs[ICl2] → 2 CsCl + ICl
用途
氯化铯在原子能工业中和氯化钚配对,熔盐电解制备金属钚。氯化铯溶液在生物研究上广泛用于离心分离病毒和其他分子。很稀的氯化铯能提高乙酰胆碱酯酶的活性。
1.用作分析试剂,如作显微镜分析、光谱分析试剂。还用于医药工业、铯盐制造、X射线荧光屏和光电管材料。
2.气相色谱固定液,用于三价铬和镓的点滴分析、二联苯和三联苯的高温色谱分析。用于制取金属铯、铯盐和及作为铯单晶的原料。[1]
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.