溴化鈹
溴化鈹是一種鈹的化合物,是一種溴化鹽類,分子式為BeBr2,通常外觀為半透明白色固體。具有吸濕性、易朝解,能溶於水,且溶解度高。
| 溴化鈹 | |
|---|---|
 | |
| IUPAC名 Beryllium bromide | |
| 识别 | |
| CAS号 | 7787-46-4 |
| PubChem | 82230 |
| ChemSpider | 74208 |
| SMILES |
|
| InChI |
|
| InChIKey | PBKYCFJFZMEFRS-NUQVWONBAJ |
| 性质 | |
| 化学式 | BeBr2 |
| 摩尔质量 | 168.820 g/mol g·mol⁻¹ |
| 外观 | 無色白色固體結晶 |
| 密度 | 3.465 g/cm3 (20 °C)[1] |
| 熔点 | 508°C [1] |
| 沸点 | 520°C[2][1] |
| 升华条件 | 473°C [3] |
| 升华条件 | 473°C [3] |
| 溶解性(水) | 高溶解度[2] |
| 溶解性(乙醇) | 可溶[4] |
| 结构 | |
| 晶体结构 | 正交晶系 |
| 热力学 | |
| ΔfHm |
-2.094 kJ/g |
| S |
9.5395 J/K |
| 热容 | 0.4111 J/g K |
| 危险性[5] | |
| 警示术语 | R:R49-R25-R26-R36/37/38-R43-R48/23-R51/53 |
| 安全术语 | S:S45-S53-S61 |
GHS危险性符号   | |
| H-术语 | H350, H330, H301, H372, H319, H335, H315, H317, H411 |
| 主要危害 | 鈹中毒 |
| 相关物质 | |
| 其他阴离子 | 氟化鈹 氯化鈹 碘化鈹 |
| 其他阳离子 | 溴化鎂 溴化鈣 溴化鍶 溴化鋇 溴化鐳 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
制備
溴化鈹是可用氧化鈹和碳的混合物,放在充滿氣態溴的容器或室中加熱至1100°C到1200°C,氧化鈹和碳的混合物可能會在氣態溴中燃燒並生成溴化鈹。它有副產物一氧化碳。[6]
也可以直接用元素單質制取[3]:可用鈹金屬和氣態溴加熱至500°C 至 700°C[2],鈹金屬可能會在氣態溴中燃燒並生成溴化鈹[6]:
- BeO + 2 HBr(aq) → BeBr2(aq) + H2O
只要使BeBr2(aq)結晶即可。
分子結構
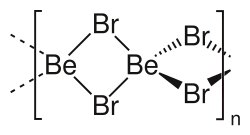
溴化鈹是一個非常吸濕性白色粉末,晶體結構為正交晶系[3]晶格參數為 a =10.32Ǻ,B=5.52Ǻ和c=5.54Ǻ[6]它的結合能有9.80kJ/mol。[3]在氣態時分子結構為一個二聚體。[6]
參考文獻
- Datenblatt 溴化鈹 bei AlfaAesar, abgerufen am 28. May 2010.
- Perry, Dale L.; Phillips, Sidney L., , CRC Press: 61–62, 1995 [2007-12-10], ISBN 0-8493-8671-3
- D. L. Perry, S. L. Phillips: "Handbook of Inorganic Compounds", CRC Press (1995). p. 61-62. Auszug bei books.google.com.
- Parsons, Charles Lathrop, , Easton, Pa.: Chemical Publishing: 21–22, 1909 [2007-12-10]
- Record of CAS RN 7787-46-4 in the GESTIS Substance Database from the IFA.
- Kenneth A. Walsh: "Beryllium chemistry and Processing", ASM International (2009). S. 120f. (溴化鈹 在 Google Books 的內容。)
- C. L. Parsons: "The Chemistry and Literature of Beryllium", Chemical Publishing (1909). Volltext
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
