Prilezhaev反应
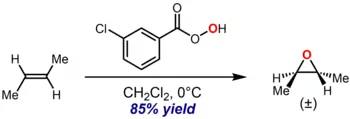
Prilezhaev反应,又称Prileschajew反应或Prilezhaev环氧化反应,为烯烃与过氧酸形成环氧化物的化学反应。[1]该反应由尼古拉·普里列扎耶夫(Nikolai Prilezhaev)于1909年首次报告,并因此得名。[2]该反应常用的过氧酸为间氯过氧苯甲酸(m-CPBA),因其性质相对稳定,且在大多数有机溶剂中有较好的溶解度。[3]如下所示的反应实例中,mCBPA使反-2-丁烯环氧化,得到反-2,3-环氧丁烷:[4]
| Prilezhaev反应 | |
|---|---|
| 命名根据 | 尼古拉·普里列扎耶夫 |
| 反应类型 | 杂环合成反应 |
| 标识 | |
| 有机化学网站对应网页 | prilezhaev-reaction |
| RSC序号 | RXNO:0000405 |
该反应有高度立体专一性,C=C双键的立体异构通常可以完全保真地在环氧化物中得以保持。所以反式烯烃仅会形成反式环氧化物(如上例所示),而顺式烯烃只会产生顺式环氧化物。这种立体专一性是协同反应机理的结果,具体如下所述。
反应机理
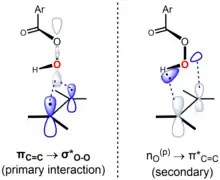
目前普遍承认的Prilezhaev反应机理为Paul Bartlett首先提出的“蝴蝶机理”。在该机理中,过氧酸在反应过渡态中形成分子内氢键。[5]尽管在两个方向上都存在前线轨道轨道相互作用,但过氧酸通常被视为亲电体,而烯烃则被视为亲核体。可以印证这一规律的是,C=C双键上的电子云密度越大,环氧化反应的速率通常越快。例如,随着烯烃上取代的甲基数量增加,环氧化反应的相对速率变化如下:乙烯(1,无甲基)<丙烯(24,一个甲基)<顺-2-丁烯(500,两个甲基)<2-甲基-2-丁烯(6500,三个甲基)<2,3-二甲基-2-丁烯(>6500,四个甲基)。甲基的超共轭效应增加了双键的电子密度,导致了环氧化反应的速率变化。
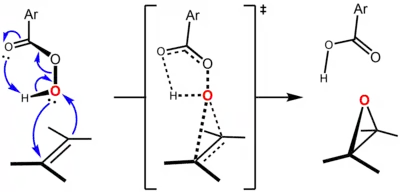
Prilezhaev反应属协同反应机理,具有同步(或近同步)的过渡态。[6]在“蝴蝶机理”的过渡态构型中,过氧酸所在平面将烯烃所在平面一分为二,过氧O-O键垂直于烯烃双键。这种构象使关键的前线轨道相互作用得以进行。其中主导性的相互作用为占据的πC=C轨道(HOMO)和未占的σ*O-O轨道(LUMO)间的相互作用,该相互作用可解释反应中烯烃的亲核性与过氧酸的亲电性。反应的次要相互作用为垂直于过氧酸平面的孤对电子轨道nO(p)(HOMO)与未占据的π*C=C轨道(LUMO)之间的相互作用。[lower-alpha 1][7]根据Anslyn & Dougherty (2006, p. 556),环氧化反应的机理可以表示如下:[8]
Prilezhaev反应速率与溶剂的选择极度相关。[9]
参见
- 人名反应列表
- 环氧化合物
- 其它的C=C双键环氧化反应:Sharpless环氧化反应、Jacobsen环氧化反应、史氏环氧化反应
注解
注释
- 大多数教科书仅使用四个箭头来描述反应机理,O-H键被用作形成第二个C-O键的电子源。尽管这种描述在形式上是正确的,但根据反应涉及的前线轨道相互作用的讨论,最好将氧原子上的孤对电子作为该C-O键的电子源,即多添加一个箭头。Anslyn & Dougherty (2006, p. 556)使用这一额外箭头的推动来描述Prilezhaev反应的机理,并讨论了使用正确的电子来源的问题(Anslyn & Dougherty 2006,第1061-1074页)。
引用
- Li, Jie Jack; Corey, E. J. . . Wiley-Interscience. 2007: 274–281. ISBN 9780470176504.
- Prileschajew, Nikolaj. [有机氧化物对未饱和化合物的氧化反应]. Berichte der deutschen chemischen Gesellschaft. 1909, 42 (4): 4811–4815 [2019-10-03]. doi:10.1002/cber.190904204100. (原始内容存档于2019-10-03) (德语).
- Kürti, László; Czakó, Barbara. . Elsevier Academic Press. 2005: 362. ISBN 978-0124297852.
- Vollhardt, K. Peter C.; Schore, Neil Eric. 6th. New York: W.H. Freeman. 2011. ISBN 9781429204941. OCLC 422757611.
- Bartlett, Paul D. . Record of Chemical Progress. 1950, 11: 47–51.
- Singleton, Daniel A.; Merrigan, Steven R.; Liu, Jian; Houk, Kendall N. . Journal of the American Chemical Society. 1997, 119 (14): 3385–3386. doi:10.1021/ja963656u.
- Evans, David A. (PDF). Harvard Department of Chemistry and Chemical Biology. 2007 [2018-12-27].
- Anslyn, Eric V.; Dougherty, Dennis A. . . University Science Books. 2006: 555–556. ISBN 9781891389313.
- Dryuk, V. G. . Tetrahedron. 1976, 32 (23): 2855–2866. doi:10.1016/0040-4020(76)80137-8.