环氧化合物
环氧化(合)物(epoxide),是含氧三元环的醚类化合物,可以看作环氧乙烷的衍生物。其中三个原子大致在一个等边三角形结构的平面上。由于张力较大,环氧化合物比其他醚更活泼,尤其是与亲核试剂反应。简单的环氧化合物可以通过它们的无氧完全饱和的母体结构来命名,比如环氧乙烷。
含有未反应环氧单元的聚合物称为:聚环氧化物或者环氧树脂。环氧树脂可以用于胶粘剂和结构材料。聚合环氧化物可以得到聚醚,比如通过环氧乙烷经过聚合反应得到聚乙二醇。
合成
工业中最主要的环氧化物是环氧乙烷和环氧丙烷,它们每年分别的产量分别约为1500万和300万吨。[1]乙烯的环氧化需要消耗的氧气当量数如下:
- 7 H2C=CH2 + 6 O2 → 6 C2H4O + 2 CO2 + 2 H2O
氧气和烯烃的直接反应仅对乙烯有效,其他烯烃甚至丙烯都不能直接反应。
烯烃环氧化
大多数的环氧化合物都是通过烯烃与过氧化物(能给出单个氧原子的试剂)反应得到的。典型的过氧化物包括了过氧化氢(双氧水)、过氧羧酸和烷基氢过氧化物。在一些特殊的应用中,其他的过氧化试剂也可以被使用,如:二甲基二氧丙环(DMDO)。
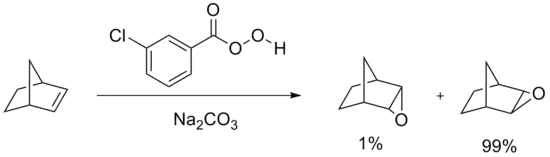
这类反应最广泛应用于合成环氧丙烷,其使用叔丁基过氧化氢(过氧化叔丁基)或乙基苯基过氧化氢与丙烯反应。[2]实验室内更为典型的过氧化反应是Prilezhaev反应。[3][4]反应使用过氧酸,如m-CPBA来氧化烯烃。图例是利用过氧苯甲酸环氧化苯乙烯得到苯乙烯氧化物:[5]
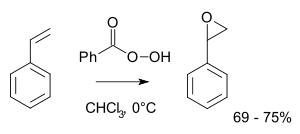 Prilezhaev反应
Prilezhaev反应
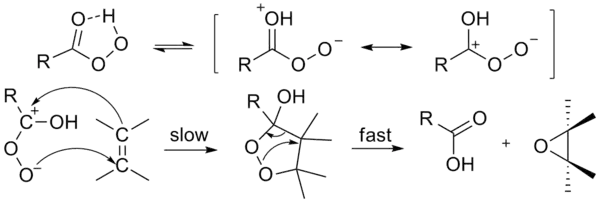
反应是通过熟知的“蝴蝶机理”进行。[6]过氧化物被认为是一种亲电试剂,而烯烃是一种亲核试剂。
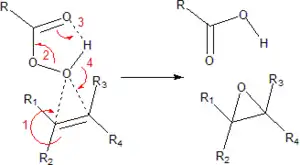 Butterfly机理
Butterfly机理
又如图例如下:
机理如下所示:
氢过氧化物同样用于不对称选择环氧化催化剂,比如Sharpless环氧化反应以及Jacobsen环氧化反应,在上述两个反应中氧原子从金属氧化物或者过氧化物被转移到底物上。它们与史氏環氧化反應在不对称手性环氧化物合成中应用广泛。哑嗪试剂也可用来转化烯烃成为过氧化物。
分子内SN2取代
这个方法是Williamson合成的衍生方法。在这个例子当中:卤代醇相邻碳上处于反式的醇盐负离子作为亲核试剂和卤素原子反应,卤素负离子离去,生成环氧化合物。[7]
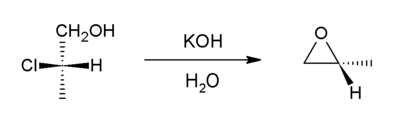
全球的大约一半的环氧丙烷就是通过这个方法制备的。[2]醛或酮在强碱(如醇钠、氨基钠等)的作用下和一个α-卤代羧酸酯进行Darzen反应,生成α,β-环氧酸酯,该人名反应的关键步骤就是该反应。在Johnson-Corey-Chaykovsky反应中,通过羰基基团和硫叶立德反应生成环氧化合物。在这个反应当中,硫代替了氯作为离去基团。
亲核环氧化
缺电子的烯烃,比如烯酮或者丙烯衍生物可以使用亲核的含氧化合物比如过氧化物来进行环氧化反应。这个反应是两步反应历程,第一部是氧原子进行亲核共轭加成反应得到一个稳定的碳负离子,然后碳负离子进攻相同的氧原子,取代一个离去基团并关环。
不对称环氧化
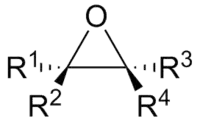
环氧化合物的碳原子是sp3-杂化的,而可能形成一个手性中心。环氧化产物有可能是顺式或者反式的非对映体,这取决于反应的机理以及起始原料烯烃的立体化学。另外,如果在起始原料当中有其他的手性中心,那么环氧化还会影响到环氧基附近的手性。这种反应的非对映选择性是底物控制型的。最后,具有手性结构的环氧化试剂能够影响到环氧化试剂的手性。(参见Sharpless环氧化,Jacobsen环氧化反应,和Juliá-Colonna环氧化)。反应的对映选择性是试剂控制型的。
反应
环氧化物的典型反应如下:
- 对环氧化物的亲核加成反应既可以是酸催化也可以是碱催化。
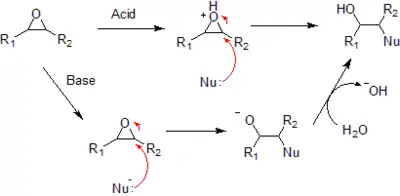 环氧化合物在酸性和碱性条件下的不同开环历程
环氧化合物在酸性和碱性条件下的不同开环历程
- 在酸性条件下,亲核试剂进攻环上可以让其形成最稳定碳正离子的碳原子,比如说取代最多的碳原子。在碱性条件下,亲核试剂进攻位阻最小,也就是取代最少的碳原子,这个过程是标准的 SN2 亲核加成反应。
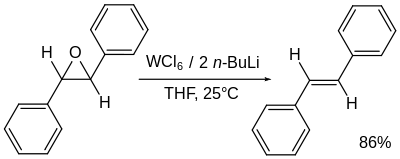 去环氧化过程
去环氧化过程
参考资料
- Siegfried Rebsdat, Dieter Mayer "Ethylene Oxide" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.doi:10.1002/14356007.a10_117 Article Online Posting Date: March 15, 2001.
- Dietmar Kahlich, Uwe Wiechern, Jörg Lindner “Propylene Oxide” in Ullmann's Encyclopedia of Industrial Chemistry, 2002 by Wiley-VCH, Weinheim. doi:10.1002/14356007.a22_239Article Online Posting Date: June 15, 2000
- March, Jerry. 1985. Advanced Organic Chemistry, Reactions, Mechanisms and Structure. 3rd ed. John Wiley & Sons. ISBN 0471854727.
- Nikolaus Prileschajew. . Berichte der deutschen chemischen Gesellschaft. 1909, 42 (4): 4811–4815. doi:10.1002/cber.190904204100.
- Harold Hibbert and Pauline Burt (1941). "Styrene Oxide". Org. Synth.; Coll. Vol. 1: 494.
- Bartlett Rec. Chem. Prog 1950, 11 47.
- Koppenhoefer, B.; Schurig, V. (1993). "(R)-Alkyloxiranes of High Enantiomeric Purity from (S)-2-Chloroalkanoic Acids via (S)-2-Chloro-1-Alkanols: (R)-Methyloxirane". Org. Synth.; Coll. Vol. 8: 434.
- K. Barry Sharpless, Martha A. Umbreit, Marjorie T. Nieh, Thomas C. Flood. . J. Am. Chem. Soc. 1972, 94 (18): 6538–6540. doi:10.1021/ja00773a045.
参见
- 环氧树脂
- 聚醚
- 环氧化物水解酶
- Juliá-Colonna环氧化
- Johnson-Corey-Chaykovsky反应
外部連結
| 查询維基詞典中的。 |