α螺旋
α螺旋(alpha helix (α-helix);Pauling–Corey–Branson α-helix;3.613-helix)是蛋白质的二级结构。它和β折叠一起被称为「规则二级结构」,因为他们都具有重复的Φ和Ψ值(Cα-N夹角和Cα-C夹角)。
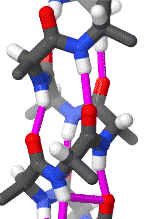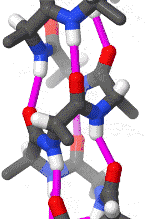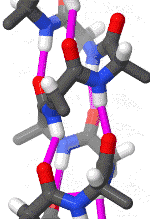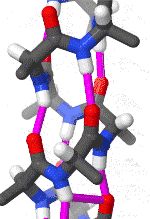
聚丙氨酸形成的α螺旋结构的三維面观
α螺旋一般是右手螺旋。在α螺旋中,平均每个螺旋周期包含3.6个氨基酸残基,残基侧链伸向外侧,同一肽链上的每个残基的酰胺氢原子和位于它后面的第4个残基上的羰基氧原子之间形成氢键,H-O距离是2.8Å。这种氢键大致与螺旋轴平行。一条多肽链呈α螺旋构象的推动力就是所有肽键上的酰胺氢和羰基氧之间形成的链内氢键。在水环境中,肽键上的酰胺氢和羰基氧既能形成内部(α螺旋内)的氢键,也能与水分子形成氢键。如果后者发生,多肽链呈现类似变性蛋白质那样的伸展构象。疏水环境对于氢键的形成没有影响,因此,更可能促进α螺旋结构的形成。
α螺旋中,氨基酸的R基团指向外和向下。这样以来就避免了与多肽链的主干部分之间的的位阻影响。螺旋的核心部分紧密结合,原子之间以凡得瓦力联系在一起。
因为其特殊的环状R基团,脯氨酸一般不出现在α螺旋中,而经常出现在α螺旋的开始处。
资料来源
- Donald Voet, Judith G. Voet, Charlotte Pratt. Fundamentals Of Biochemistry, upgrade edition
延伸閲讀
- Tooze J, Brändén CI. . New York: Garland Pub. 1999. ISBN 0-8153-2304-2..
- Eisenberg D. . Proceedings of the National Academy of Sciences of the United States of America. September 2003, 100 (20): 11207–10. Bibcode:2003PNAS..10011207E. PMC 208735. PMID 12966187. doi:10.1073/pnas.2034522100.
- Astbury WT, Woods HJ. . Nature. 1931, 127 (3209): 663–665. Bibcode:1931Natur.127..663A. doi:10.1038/127663b0.
- Astbury WT, Street A. . Trans. R. Soc. Lond. 1931, A230: 75–101. Bibcode:1932RSPTA.230...75A. doi:10.1098/rsta.1932.0003.
- Astbury WT. . Trans. Faraday Soc. 1933, 29 (140): 193–211. doi:10.1039/tf9332900193.
- Astbury WT, Woods HJ. . Philosophical Transactions of the Royal Society of London Series A. 1934, 232 (707–720): 333–394. Bibcode:1934RSPTA.232..333A. doi:10.1098/rsta.1934.0010.
- Astbury WT, Sisson WA. . Proceedings of the Royal Society. 1935, A150 (871): 533–551. Bibcode:1935RSPSA.150..533A. doi:10.1098/rspa.1935.0121.
- Sugeta H, Miyazawa T. . Biopolymers. 1967, 5 (7): 673–679. doi:10.1002/bip.1967.360050708.
- Wada A. . Advances in Biophysics. 1976: 1–63. PMID 797240.
- Chothia C, Levitt M, Richardson D. . Proceedings of the National Academy of Sciences of the United States of America. October 1977, 74 (10): 4130–4. Bibcode:1977PNAS...74.4130C. PMC 431889. PMID 270659. doi:10.1073/pnas.74.10.4130.
- Chothia C, Levitt M, Richardson D. . Journal of Molecular Biology. January 1981, 145 (1): 215–50. PMID 7265198. doi:10.1016/0022-2836(81)90341-7.
- Hol WG. . Progress in Biophysics and Molecular Biology. 1985, 45 (3): 149–95. PMID 3892583. doi:10.1016/0079-6107(85)90001-X.
- Barlow DJ, Thornton JM. . Journal of Molecular Biology. June 1988, 201 (3): 601–19. PMID 3418712. doi:10.1016/0022-2836(88)90641-9.
- Murzin AG, Finkelstein AV. . Journal of Molecular Biology. December 1988, 204 (3): 749–69. PMID 3225849. doi:10.1016/0022-2836(88)90366-X.
外部連結
- NetSurfP ver. 1.1 - Protein Surface Accessibility and Secondary Structure Predictions 页面存档备份,存于
- α-helix rotational angle calculator
- Artist Julie Newdoll's website 页面存档备份,存于
- Artist Julian Voss-Andreae's website 页面存档备份,存于
template:Spirals
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
