五氟化铋
| 五氟化铋 | |
|---|---|
 | |
 | |
| 别名 | 氟化铋(V) |
| 识别 | |
| CAS号 | 7787-62-4 |
| PubChem | 123260 |
| ChemSpider | 21172752 |
| SMILES |
|
| InChI |
|
| InChIKey | MELFHUKMGVSOTN-COTDSHSIAY |
| ChEBI | 30426 |
| 性质 | |
| 化学式 | BiF5 |
| 摩尔质量 | 303.97 g·mol⁻¹ |
| 外观 | 白色针状晶体[1]或无色晶体[2] |
| 密度 | 5.40 g cm−3[1] |
| 熔点 | 151.4 °C[2], 154.4 °C[1] |
| 沸点 | 230 °C[1][2] |
| 结构 | |
| 配位几何 | 正八面体 |
| 相关物质 | |
| 其他阴离子 | 三氯化铋、三溴化铋、三碘化铋、五甲基铋 |
| 其他阳离子 | 五氟化磷、五氟化砷、五氟化锑 |
| 相关化学品 | 三氟化铋 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
结构
BiF5固态时是多聚体,由反式桥连的线型链共用BiF6八面体的一个角形成。[1][3] 这种结构与α-UF5是相同的,却与三氟化铋(BiF3)不同,这是一种离子化合物并采用YCl3结构。[1]
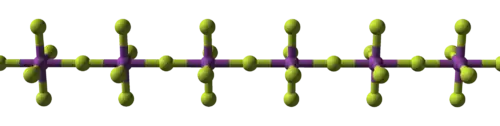  |   |
制法
BiF5可以通过BiF3与F2在500 °C下反应制备:[2]
- BiF3 + F2 → BiF5
另一种合成方法是在350 °C下使用ClF3作为氟化剂:[4]
- BiF3 + ClF3 → BiF5 + ClF
反应
五氟化铋是最活泼的VA族元素五氟化物,它也是一个很强的氟化剂。它与水剧烈反应产生臭氧、二氟化氧以及棕色沉淀(可能是水合氟氧化铋(V)),与碘或硫在室温下即可反应。BiF5可以在50 °C以上将煤油(碳氢化合物)氟化成碳氟化合物,并能在150 °C下将UF4氧化成UF6。温度达到180 °C时,五氟化铋甚至能将Br2氟化成BrF3,将Cl2氟化成ClF。[1]
参考资料
- Greenwood, Norman N.; Earnshaw, Alan., 2nd, Oxford: Butterworth-Heinemann: 561–563, 1997, ISBN 0080379419
- Holleman, A. F.; Wiberg, E., , San Diego: Academic Press: 769–770, 2001, ISBN 0-12-352651-5
- C. Hebecker. . Z. anorg. allg. Chem. 1971, 384 (2): 111–114. doi:10.1002/zaac.19713840204.
- A. I. Popov, A. V. Scharabarin, V. F. Sukhoverkhov, N. A. Tchumaevsky. . Z. anorg. allg. Chem. 1989, 576 (1): 242–254. doi:10.1002/zaac.19895760128.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
