铋
铋(Bismuth)是一種元素,化學符號是Bi,原子序是83。它是一種五價的后过渡金属元素(p区贫金属),跟氮元素同族,化學性質類似砷和锑。鉍可以在自然界中找到,而且它的硫化物和氧化物是重要的商業礦石。純鉍的密度是純鉛的86%。它剛產出時是銀白色易脆金屬,但表面氧化後呈粉紅色。铋是天然的反磁性金属,也是金屬中熱導率最低的元素之一。
铋長期以來一直被認為是具有最高原子量的穩定元素,但是2003年有人發現它有極其微弱的放射性。鉍唯一的天然同位素鉍209會進行α衰變,而鉍209的半衰期超過宇宙年齡的十億倍。由於鉍的半衰期極長,所以還是可以將它應用在幾乎所有地方。
用途
目前在鉍的產量中,其化合物態就佔了一半。鉍常用於化妝品、顏料或一些藥物,比如治療腹瀉的鹼式水楊酸鉍 。因為鉍在凝固的時候會異常膨脹, 所以適合用於某些地方,例如印刷鑄件。鉍在重金屬中毒性比較低,隨著人們越來越重視鉛的毒性,鉍合金(大約是鉍產量的三分之一)越來越常作為鉛的替代品。
歷史
古時候人們就已經知道鉍金屬的存在了,儘管它很常因為相似的物性而跟鉛或錫搞混。鉍的英文名稱來源Bismuth並不確定,但是可能來自bi ismid(阿拉伯文)或weiße Masse、 wismuth(德文)。鉍在十六世紀中葉被翻譯為新拉丁語的bismutum或bismutium。
鉍的名稱起源可以追溯到1660年代,而它的詞源不確定。鉍是最早發現的十種金屬之一。鉍出現在1660年代,可能起於Bismuth、Wismut、Wissmuth(16世紀初,德文),可能起於hwiz(意指"白色",古高地德語),也可能起於新拉丁文的雙峰會(Georgius Agricola當時對許多德國的採礦和技術詞彙進行了拉丁化處理)的Wistuth、weißeMasse(意指"白色金屬塊")。因為铋和錫以及鉛實在是太像了,所以在早期人們常常把铋跟錫、鉛搞混。由於鉍發現的很早,因此沒有人能確定它最先是被誰發現的。 Agricola(約1546年)在De Natura Fossilium指出,基於對金屬及其物理性質的觀察,鉍是一種獨特金屬。煉金術時代的礦工也將鉍命名為"tectum argenti"或"正在製造的銀"。
從約翰·海因里希·波特(1738年)、卡爾·威廉·舍勒和托爾貝恩·貝里曼開始,鉛和鉍的區別就變得清晰起來,克勞德·弗朗索瓦·若弗魯瓦(1753年)證明了這種金屬不同於鉛和錫。印加人也很常用到鉍,並且與常用的銅和錫一起用於特殊的刀青銅合金中。
金属冶炼

工业上将冶炼铋主要是通过氧化铋的氧化还原反应,冶炼炉中的反应方程式主要为:
- Bi2O3+3C→2Bi+3CO↑
- Bi2O3+3CO→2Bi+3CO2
其中,产生的一氧化碳还可能把杂质金属的氧化物还原:
- PbO+CO→Pb+CO2
这些杂质溶于金属铋中组成还原熔炼产物粗铋。如果铋矿中还含有铜,则通常加入黄铁矿来回收铜:
- 2Cu+FeS2→Cu2S+FeS
- Bi2S3+3Fe→2Bi+3FeS
同样,有部分杂质熔入金属铋得到粗铋。
氧化铋和硫化铋的混合矿则可以通过混合熔炼法来冶炼金属铋,冶炼过程是根据氧化铋和硫化铋彼此之间的氧化还原反应:
- Bi2S3+2Bi2O3→6Bi+3SO2↑。
湿法冶炼铋常用氯化铁-盐酸法和铁粉置换法。氯化铁-盐酸法是将硫化铋矿溶解在三氯化铁和盐酸(HCl)的混合溶液中:
- Bi2S3+6FeCl3→2BiCl3+6FeCl2+3S
其中,FeCl3还能溶解铋矿中的天然铋:
- 3FeCl3+Bi→BiCl3+3FeCl2
矿中如果有氧化铋则直接被盐酸溶解:
- Bi2O3+6HCl→2BiCl3+3H2O。
盐酸的另外一个作用是防止生成的BiCl3水解成不溶性的BiOCl沉淀。铁粉则是把生成的氯化铋中的铋置换出来:
- 3Fe+2BiCl3→2Bi+3FeCl2。
这时沉淀出来的铋为海绵状的。海绵状的铋如果直接在空气中加热会导致氧化,因此工业上的熔融铋是在熔融的氢氧化钠中进行的,这样既可以防止铋的氧化,又可以让形成的液态铋下沉易于聚集,铋中的氧化物及杂质能被氢氧化钠溶解。[2]
化学性质

铋的化学性质和砷、锑相似,常温下不与水及氧作用,因此,铋在空气中稳定。在加热至熔点时,铋表面逐渐生成灰黑色的氧化物。金属铋可以在一定条件下和卤素直接反应生成三卤化铋。高温下,金属铋能和很多非金属及金属生成三价铋的化合物,铋的还原电势为正值,即在电动序中位于氢后,所以铋不和非氧化性酸反应。铋能溶于热的浓硫酸中,也能顺利地和硝酸反应。与砷、锑不同,铋有生成含氧酸盐的明显趋势,如硫酸铋、硝酸铋、砷酸铋等。铋不和碱反应。
需要指出的是,铋与氧化剂作用时通常只生成3价铋而不是5价铋。+5氧化态的铋远不如砷(V)以及锑(V)稳定。这不仅仅是因为铋的第IV电离能及第V电离能之和(9.776mJ·mol-1),而且还因为6s2的一个电子激发到6d空轨道需要很大的能量,所以由低氧化态的铋生成Bi(V)的化合物是很困难的。[3]
此外,铋还能形成原子簇化合物。
铋唯一的天然同位素铋是铋209,在传统上也被视为最重的稳定同位素,但它长期以来一直怀疑是不稳定的。在2003年,研究人员在法国的l'Institut d'Astrophysique Spatiale d'Orsay,测得铋209的半衰期为1.9×1019 年 ,相当于现在宇宙年龄的十亿倍。由于其特别长的半衰期,在所有目前已知的医疗和工业应用中,铋可以被视为稳定的非放射性元素。而对它的放射性的研究是纯粹是学术兴趣,因为铋是放射性首先在理论上被怀疑而不会在实验室中被发现的少数几个元素。铋具有已知最长的α衰变半衰期,虽然碲-128具有双重β衰变以上的半衰期 2.2×1024 年。
具有短半衰期的几种同位素也已被发现,可以衰变为锕,镭和钍。铋213还被发现可以由铀233衰变而成。
在商业上,放射性同位素铋-213可以通过直线粒子加速器轰击产生镭用於制造辐射。在1997年,抗体结合物与铋213,其具有45分钟的半衰期和衰变与α粒子的排放,被用来治疗白血病。这种同位素也已尝试在癌症治疗中使用,例如靶向α治疗(TAT)程序。
化合物
鉍可以形成三價和五價化合物,三價化合物較為常見。它的許多化學性質類似於砷和銻,儘管它們的毒性低於那些較輕元素的衍生物的毒性。
氧化物和硫化物
在高溫下,金屬鉍会和蒸氣與氧迅速結合,形成黃色的Bi
2O
3。[4][5] [6] 熔融時,在710℃以上的溫度中,這種氧化物會腐蝕任何金屬氧化物,甚至是鉑。在與鹼反應時,它會形成兩種含氧離子系列:BiO−
2 (其聚合物為線性鏈);和BiO3−
3。Li
3BiO
3的負離子Bi
8O24−
24實際上是立方八聚體陰離子,而Na
3BiO
3中的負離子則是四聚體。[7]
深紅色的鉍(V)氧化物Bi
2O
5不穩定,加熱時會釋放出O
2。[8]
Bi
2S
3存在於天然的鉍礦石中。它是由熔融的鉍和硫結合產生的。[10] [11]
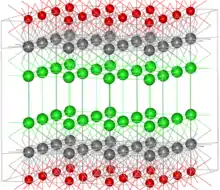
氯氧化鉍(BiOCl,請參見右圖)和硝酸氧鉍(BiONO3)在化學計量上以鉍(III)陽離子(BiO +)的簡單陰離子鹽的形式出現,其通常在含水鉍化合物中出現。然而,在BiOCl的情況下,鹽晶體以Bi、O和Cl原子的交替板的結構形成,其中每個氧在相鄰平面中與四個鉍原子配位。這種礦物化合物被用作顏料和化妝品(見下文)。[12]
氫化鉍(III)和鉍化物
與較輕的氮族元素氮、磷和砷不同,但與銻相似,鉍不能形成穩定的氫化物。氫化鉍 (BiH
3)是在室溫下自發分解的吸熱化合物。它僅在-60°C以下穩定。[7]鉍化物是鉍與其他金屬之間的金屬間化合物。
在2014年,研究人員發現,鉍鈉可以以一種稱為“三維拓撲狄拉克半金屬”(3DTDS)的形式存在,該物質散裝具有3D狄拉克費米子。它是石墨烯的天然三維對應物,具有相似的電子移動率和漂移速度。石墨烯和拓撲絕緣體(例如3DTDS中的絕緣體)都是晶體材料,它們在內部是與電絕緣的, 但在表面上是可以導電的,從而可使用在電晶體和其他電子設備上。儘管鉍鈉(Na
3Bi)太不穩定,以至於無法在沒有包裝的設備中使用, 但它仍可以展示出3DTDS系統的潛在應用,且在半導體和自旋電子學的應用中, 它與平面石墨烯相比, 具有明顯的效率和製造優勢。
[13][14]
鹵化物
低氧化態的鉍鹵化物已被證明具有不同尋常的結構。最初被認為是氯化鉍(I)(BiCl),結果是由Bi5+
9陽離子和BiCl2−
5、Bi
2Cl2−
8陰離子組合成的複合化合物。
[7][15]Bi5+
9陽離子具有扭曲的三鍵三角柱狀分子幾何形狀, 也存在於Bi
10Hf
3Cl
18之中,Bi
10Hf
3Cl
18是通過將氯化鉿(IV)和氯化鉍與元素鉍的混合物還原而製成的,具有[Bi+
]、[Bi5+
9]、[HfCl2−
6]
3的結構。[7]:50其他多原子鉍陽離子也已經被知悉,例如:在Bi
8(AlCl
4)
2中被發現的Bi2+
8。[15] 鉍也能形成具有與“BiCl”相同結構的低價溴化物。另外,還有一個真正的單一碘化物BiI,它包含Bi
4I
4單元鏈。BiI可加熱分解為BiI
3和元素鉍。此外,也存在有相同結構的一溴化物。[7]
在氧化態為+3時,鉍與所有的鹵素(即BiF
3、BiCl
3、BiBr
3、BiI
3 )都會形成三鹵化物。這些鹵素除了BiF
3之外,都會被水水解。[7]
氯化鉍(III)與氯化氫在乙醚溶液中會反應生成酸HBiCl
4。[16]
鉍很少出現+5的氧化態。其中一種這樣的化合物便是BiF
5,一種強效的氧化劑和氟化劑。它也是強氟化物的受體,会與四氟化氙反應形成XeF+
3陽離子[16]:
- BiF
5 + XeF
4 → XeF+
3BiF−
6
產地和生產

在地殼中,鉍的含量大約是金的兩倍。鉍最重要的是礦石是砷鉍礦和輝鉍礦。天然鉍礦的產地主要來自澳洲、玻利維亞和中國。[19][20][21]
根據美國地質調查局的研究,2016年全球鉍的採礦產量為10,200公噸,主要產自中國(7,400噸)、越南(2,000噸)、墨西哥(700噸)。[22] 2016年的全球精煉廠產量則為17,100噸,其中中國生產11,000噸、墨西哥539噸、日本428噸。[23] 這個數量上的差異顯示出,鉍的地位是作為提取其他金屬(例如:鉛、銅、鋅、錫、鉬、鎢等)的副產品。 精煉廠生產的全球鉍產量的統計數據是較為完整與可靠的。[24] [25][26][27]
鉍存在於粗鉛锭中(含鉍量高達10%),經過數個精煉的階段,直到透過白特頓-克洛耳法的程序將之分離出來例如爐渣等的雜質,或是以貝滋電解法將之提煉出來。鉍與另一種主要金屬銅的作用相似。[25] 生鉍礦經過上述兩種處理程序後,仍存有相當多的其他金屬,其中最主要的是鉛。藉由熔融混合物與氯氣反應,其他金屬可以轉化為氯化物,而鉍則仍保持不變。雜質也可以透過各種其他方法去除,例如:使用助熔劑等處理方法,來製成高純度的鉍金屬(Bi含量超過99%)。
價格

鉍金屬全球產量和年平均價格 在20世紀的大部分時間裡,純鉍金屬的價格一直相對地穩定,除了1970年代的飆升之外。鉍一直以來是主要作為提煉鉛的副產品而生產的,因此價格通常反映出生產、需求和回收成本之間的平衡。[28]
在第二次世界大戰之前,對鉍的需求很小,而且主要是用在醫藥上--鉍化合物被用來治療消化系統的疾病、性傳播疾病和燒傷等。少數鉍金屬則是用在消防噴水系統和保險絲的易熔合金上。 在第二次世界大戰期間,鉍被認為是一種戰略性的材料,用於焊料、易熔合金、藥物和原子研究。 為了穩定市場,生產商在戰爭期間將價格定為每磅1.25美元(2.75美元/公斤),從1950年到1964年的價格則定為每磅2.25美元(4.96美元/公斤)。 [28]
1970年代初期,由於對於作為鋁、鐵和鋼的冶金添加劑的鉍的需求量增加,因此價格迅速上漲。 隨後由於全球產量增加、消耗量穩定,以及1980年、1981年至1982年的經濟衰退,其價格下降。到了1984年,隨著全球消費量的增加,價格又開始攀升,特別是在美國和日本。在1990年代初期,開始對鉍進行評估研究,因為鉍可以作為鉛的無毒替代品,例如用於:陶瓷釉料、魚墜、食品加工設備、管線應用的車床加工黃銅、潤滑油脂和水禽狩獵。[29] 儘管得到了美國聯邦政府的鉛替代政策的支持,在1990年代中期,在這些領域中鉍的使用率依然增長緩慢,直到2005年左右,增長有所加劇,導致價格迅速且持續地上漲。[28]
應用
鉍在商業上的應用不多,且需要使用的量通常相對於其他原材料較少。在美國,2016年消耗了733噸鉍,其中70%用於化學品(包括藥品、顏料和化妝品),11%用於鉍合金。
一些製造商使用鉍作為閥門等飲用水系統設備的替代品,以滿足美國的“無鉛”要求(始於2014年)。這是一個相當廣泛的應用,因為它涵蓋了所有住宅和商業建築。[31]
在1990年代初期,研究人員開始評估將鉍作為鉛的無毒替代品的可行性。
藥理學
鉍是一些藥物的成分[32],但其中部分藥物的用量逐漸下降[33]。
- 次水楊酸鉍作為止瀉劑。例如"粉紅鉍"製劑中Pepto-Bismol的活性成分,以及2004年Kaopectate的重新配製版本。它還用於治療一些胃腸疾病[34]及鎘中毒。儘管在某些情況可能涉及微動力作用(小劑量重金屬離子對微生物的毒性作用),但是仍不清楚完整的作用機理。 該化合物水解產生的水楊酸對於會產生毒素的大腸桿菌(旅行者腹瀉[35]中的重要病原體)具有抗菌作用。
- 次水楊酸鉍和檸檬酸鉍的組合可用於治療細菌引起的胃潰瘍。
- 鉍溴酚是一種含鉍的有機化合物,可用於治療眼部感染。
- Bismuth subgallate — Devrom裡的活性成分,作為除臭劑以治療胃脹氣和糞便中的惡臭。
- 一些鉍化合物(包括酒石酸鉍鈉)以前被用於治療梅毒[36][37]。
- "鉍乳"(氫氧化鉍和次碳酸鉍的懸浮液)在20世紀初被作為助消化藥物銷售。
- 次硝酸鉍和次碳酸鉍也被用於醫學中。
化妝品和顏料
氧氯化鉍(III)(BiOCl)有時用於化妝品中,作為眼影,髮膠和指甲油中的顏料[38][39]。這種化合物是一種礦物質雙晶石,並且以晶體形式包含原子層,其以光為基礎折射光,產生類似於珍珠母珍珠層的虹彩外觀。它曾在古埃及等其他地方作為化妝品。鉍白(又稱西班牙白),是一種白色顏料,它包括氧綠化鉍(III)或硝酸氧鉍(III)。釩酸鉍是一種具有光穩定性的非反應性塗料,通常作為毒性較強的硫化鎘黃和橙黃色顏料的替代品。我們常用在檸檬黃色顏料,而且和原本的含鎘顏料在視覺上無法區分。
金屬和合金
鉍和鐵等金屬可製造合金,用於自動噴水滅火系統。它也被用來製造青銅時代使用的鉍青銅。
鉛的代替品
因為鉛(11.32克/立方公分)和鉍(9.78克/立方公分)之間的密度差異小,在子弹和配重等方面,鉍可以代替鉛。例如,它可以取代鉛製造鉛墜。現已替代鉛彈作為鎮暴霰彈槍中的彈藥。荷蘭,丹麥,英國,威爾斯,美國和許多其他國家現在禁止使用鉛彈來捕獵濕地的鳥類,因為許多鳥類以為鉛彈可幫助消化而誤食,導致鉛中毒。而荷蘭甚至禁止在所有狩獵行為中使用鉛彈。鉍錫合金子彈是一種替代方案,其性能與鉛彈相似。(另一種較便宜但性能較差的替代品是“鋼”彈) 然而,鉍由於缺乏可塑性而不適合用作為狩獵子彈。
鉍是一種高原子量的緻密元素,浸漬鉍的乳膠護罩用於阻擋醫學檢查(如電腦斷層掃描)中的X射線,一般認為它是無毒的[40]。
危害性物質限制指令(RoHS)減少了鉛的使用,並擴大鉍在電子產品中作為低熔點焊料的成分,作為傳統錫鉛焊料的替代品。它的低毒性使它可作為食品加工設備和銅水管的焊料,而在歐盟,它也被應用於汽車工業。
鉍已被評估為用於管道應用的易切削黃銅中的鉛的替代品[41],雖然它和含鉛鋼的性能不同。
其他金屬用途和特殊合金
大部分的鉍合金熔點很低,可用於特殊用途如焊料。火災探測和撲滅系統中的許多自動灑水器、電熔斷器和安全裝置常見到易熔的In19.1-Cd5.3-Pb22.6-Sn8.3-Bi44.7合金,熔點為47°C(117°F)。這是一個方便的溫度,因為在正常的生活條件下不太可能超過該溫度。會在70°C熔化的Bi-Cd-Pb-Sn合金,可用於汽車和航空工業。在薄壁金屬零件變形之前,先填充熔融液或覆蓋一層薄薄的合金以減少斷裂的機會,然後將零件浸入沸水中以除去合金。
鉍用於製造易切削鋼和易切削鋁合金,以實現精密加工性能。因為鉛的凝固收縮和鉍的膨脹幅度差不多,因此鉛和鉍的含量通常一樣[42][43]。含相同比例的鉍鉛合金在熔化、凝固時變化不明顯。這樣的合金可用於高精度鑄造中,例如在牙科領域可以創建模型和模型。鉍還用作鍛鑄鐵的合金劑和熱電偶材料。
鉍還會用在鋁矽合金中,用來改善矽的型態[44][45]。一些鉍合金(例如Bi35-Pb37-Sn25)會與不粘材料(雲母、玻璃、搪瓷)結合使用。因為它們很容易潤濕,從而可以與其他零件接合。在銫中添加鉍可以提高銫陰極的產率。鉍粉和錳粉在300°C的溫度下燒結會產生永久磁鐵和磁致伸縮材料,可於10–100 kHz範圍內的超聲波發生器和接收器以及磁存儲設備中工作。
鉍化合物的其他用途
- 鉍包含在鉍鍶鈣氧化銅(BSCCO)中,鉍鍶鈣氧化銅是1988年發現的一群類似超導化合物,具有最高超導轉變溫度。
- 次硝酸鉍是製造虹彩釉料的一種成分,用作油漆中的顏料。
- 碲化鉍是一種半導體和優良的熱電材料。碲化鉍二極管用於移動式冰箱,CPU冷卻器和紅外光分光光度計中的探測器。
- 氧化鉍的δ形式是氧的固體電解質。這種形式通常在高溫閾值以下分解,但在強鹼性溶液中可在遠低於該閾值的溫度下電鍍。
- 鍺酸鉍是一種閃爍體,廣泛用於X射線和伽馬射線探測器。
- 釩酸鉍是一種不透明的黃色顏料,被一些藝術家作為畫油畫的染料,亦被水彩顏料公司使用,主要用作替代毒性較大的硫化鎘當作黃色染料,最常被製作為檸檬色的顏料。它在抗紫外線降解性,不透明度,著色力和不易與其他顏料反應等方面與鎘顏料相同。除了作為幾種鎘黃的替代品外,它還可作為以往用鋅、鉛和鍶製成的鉻酸鹽顏料的無毒替代品。如果將釩酸鉍添加入綠色顏料及硫酸鋇(增加透明度),它也可以作為鉻酸鋇的替代品,甚至比其他的更綠。而與鉻酸鉛相比,它不會因空氣中的硫化氫而變黑(受紫外線照射將加速反應),並且具有更明亮的顏色,尤其是檸檬黃,由於產生該顏色所需的硫酸鉛百分比較高,它是最透明、無光澤且最快變黑的。它也被用來作為汽車烤漆,但由於成本較高,仍不普遍[46]。
- 作為製造丙烯酸纖維時的催化劑。
- 將 CO2 轉化為 CO 的電催化劑[47]。
- 潤滑油的成分。
毒理學與生態毒理學
參見鉍沉著症,一種因長期接觸鉍而引起的罕見皮膚病。
科學文獻指出,與其他重金屬(鉛,砷,銻等)相比,攝入一些鉍化合物對人體的毒性較小,可能是因為鉍鹽的溶解度相對較低所導致[48]。研究指出,鉍滯留於全身的生物半衰期為5天,但它會在接受鉍藥物治療的人的腎臟中積存多年[49]。
鉍可能會引發中毒,在近年來越來越普遍。與鉛中毒一樣,鉍中毒會導致在牙齦上形成黑色沉澱物,稱為鉍線[50][51]。鉍中毒或許可用二巯基丙醇治療,其療效目前尚不明確[52]。
鉍對環境的影響尚不清楚,它可能比其他的重金屬更不容易產生生物積累,而這是一個目前正在積極研究的領域[53]。
生物修復
真菌Marasmius oreades可以用來修復被鉍汙染的土壤[54]。
参考资料
- Cucka, P.; Barrett, C. S. . Acta Crystallographica. 1962, 15 (9): 865. doi:10.1107/S0365110X62002297.
- 无机化学丛书.第四卷.P472.铋的生产与应用
- 无机化学丛书.第四卷.P484.铋的化学性质
- Greenwood, p. 553.
- Krüger, p. 185
- Godfrey, S. M.; McAuliffe, C. A.; Mackie, A. G.; Pritchard, R. G. Nicholas C. Norman , 编. . Springer. 1998: 67–84. ISBN 978-0-7514-0389-3.
- Scott, Thomas; Eagleson, Mary. . Walter de Gruyter. 1994: 136. ISBN 978-3-11-011451-5.
- Greenwood, p. 578.
- . Forgotten Books. : 363 [2019-11-30]. ISBN 978-1-4400-5235-4. (原始内容存档于2020-03-21).
- . KurzweilAI. 20 January 2014 [28 January 2014]. (原始内容存档于2019-09-27).
- Liu, Z. K.; Zhou, B.; Zhang, Y.; Wang, Z. J.; Weng, H. M.; Prabhakaran, D.; Mo, S. K.; Shen, Z. X.; Fang, Z.; Dai, X.; Hussain, Z.; Chen, Y. L. . Science. 2014, 343 (6173): 864–7. Bibcode:2014Sci...343..864L. PMID 24436183. arXiv:1310.0391. doi:10.1126/science.1245085.
- Gillespie, R. J.; Passmore, J. Emeléus, H. J.; Sharp A. G. , 编. . Academic Press. 1975: 77–78. ISBN 978-0-12-023617-6.
- Persson, Ingmar. . Pure and Applied Chemistry. 2010, 82 (10): 1901–1917. doi:10.1351/PAC-CON-09-10-22.
- Näslund, Jan; Persson, Ingmar; Sandström, Magnus. . Inorganic Chemistry. 2000, 39 (18): 4012–4021. doi:10.1021/ic000022m.
- Anthony, John W.; Bideaux, Richard A.; Bladh, Kenneth W.; Nichols, Monte C. (编). (PDF). . I (Elements, Sulfides, Sulfosalts). Chantilly, VA, US: Mineralogical Society of America. [5 December 2011]. ISBN 978-0-9622097-0-3. (原始内容 (PDF)存档于2008-07-19).
- Krüger, pp. 172–173.
- Anderson, Schuyler C. (PDF). United States Geological Survey. [2019-11-30]. (原始内容存档 (PDF)于2019-01-11).
- Klochko, Kateryna. (PDF). United States Geological Survey. [2019-11-30]. (原始内容存档 (PDF)于2019-01-11).
- Krüger, p. 173.
- Ojebuoboh, Funsho K. . JOM. 1992, 44 (4): 46–49. Bibcode:1992JOM....44d..46O. doi:10.1007/BF03222821.
- Horsley, G. W. . Journal of Nuclear Energy (1954). 1957, 6 (1–2): 41. doi:10.1016/0891-3919(57)90180-8.
- Shevtsov, Yu. V.; Beizel’, N. F. . Inorganic Materials. 2011, 47 (2): 139. doi:10.1134/S0020168511020166.
- Bismuth Statistics and Information 页面存档备份,存于. see "Metal Prices in the United States through 1998" for a price summary and "Historical Statistics for Mineral and Material Commodities in the United States" for production. USGS.
- Suzuki, p. 14.
- Warburg, N. (PDF). University of Stuttgart. [5 May 2009]. (原始内容 (PDF)存档于25 February 2009). 已忽略未知参数
|df=(帮助) - Klochko, Kateryna. . www.usgs.gov. United States Geological Survey. [2020-01-03]. (原始内容存档于2020-01-03).
- Kean, Sam. . http://worldcat.org/oclc/935530837. ISBN 978-1-4464-3765-0. OCLC 935530837. 缺少或
|title=为空 (帮助) - . Wikipedia. 2019-12-18 [2020-01-03]. (原始内容存档于2020-03-31) (英语).
- . www.cdc.gov. 2019-01-17 [2020-01-03]. (原始内容存档于2020-03-09) (美国英语).
- Sox, T E; Olson, C A. . Antimicrobial Agents and Chemotherapy. 1989-12, 33 (12): 2075–2082 [2020-01-03]. ISSN 0066-4804. PMID 2694949. (原始内容存档于2020-03-31).
- Parnell, R. J. G. . Proceedings of the Royal Society of Medicine. 1924, 17 (War Sect): 19–26 [2020-01-03]. ISSN 0035-9157. PMC 2201253. PMID 19984212. (原始内容存档于2020-03-31).
- , 1924-09-09 [2020-01-03], (原始内容存档于2020-01-05) (英语)
- Maile, Frank J.; Pfaff, Gerhard; Reynders, Peter. . Progress in Organic Coatings. 2005-11, 54 (3): 150–163. ISSN 0300-9440. doi:10.1016/j.porgcoat.2005.07.003.
- Pfaff, Gerhard. . Vincentz Network GmbH & Co KG https://books.google.com/books?id=Q1Pc0aY-vg4C&pg=PA36. 2008 [2020-01-03]. ISBN 978-3-86630-905-0. (原始内容存档于2020-03-16) (英语). 缺少或
|title=为空 (帮助) - Hopper, K D; King, S H; Lobell, M E; TenHave, T R; Weaver, J S. . Radiology. 1997-12, 205 (3): 853–858. ISSN 0033-8419. doi:10.1148/radiology.205.3.9393547.
- La Fontaine, A.; Keast, V.J. . Materials Characterization. 2006-12, 57 (4-5): 424–429. ISSN 1044-5803. doi:10.1016/j.matchar.2006.02.005.
- Llewellyn, David; Hudd, Roger. . Elsevier https://books.google.com/books?id=Wl1azjcJblIC&pg=PA239. 1998-02-24 [2020-01-03]. ISBN 978-0-08-051776-6. (原始内容存档于2020-03-14) (英语). 缺少或
|title=为空 (帮助) - Davis, Joseph R. . ASM International https://books.google.com/books?id=Lskj5k3PSIcC&pg=PA41. 1993 [2020-01-03]. ISBN 978-0-87170-496-2. (原始内容存档于2020-03-21) (英语). 缺少或
|title=为空 (帮助) - FARAHANY, S; OURDJINI, A; IDRIS, M H; THAI, L T. . Bulletin of Materials Science. 2011-10, 34 (6): 1223–1231. ISSN 0250-4707. doi:10.1007/s12034-011-0239-5.
- FARAHANY, S.; OURDJINI, A.; IDRIS, M.H.; THAI, L.T. . Transactions of Nonferrous Metals Society of China. 2011-07, 21 (7): 1455–1464. ISSN 1003-6326. doi:10.1016/s1003-6326(11)60881-9.
- Tücks, Andreas; Beck, Horst P. . Dyes and Pigments. 2007-01, 72 (2): 163–177. ISSN 0143-7208. doi:10.1016/j.dyepig.2005.08.027.
- DiMeglio, John L.; Rosenthal, Joel. . Journal of the American Chemical Society. 2013-06-19, 135 (24): 8798–8801 [2020-01-03]. ISSN 0002-7863. PMC 3725765. PMID 23735115. doi:10.1021/ja4033549. (原始内容存档于2020-03-31).
- DiPalma, Joseph R. . Emergency Medicine News. 2001-04, 23 (3): 16. ISSN 1054-0725. doi:10.1097/00132981-200104000-00012.
- FOWLER, BRUCE A.; SEXTON, MARY J. . . Elsevier. 2007: 433–443. ISBN 978-0-12-369413-3.
- Levantine, Ashley; Almeyda, John. . British Journal of Dermatology. 1973-07, 89 (1): 105–112. ISSN 0007-0963. doi:10.1111/j.1365-2133.1973.tb01932.x.
- . TheFreeDictionary.com. [2020-01-03]. (原始内容存档于2020-03-09).
- . Drugs.com. [2020-01-03]. (原始内容存档于2016-12-21) (英语).
- (PDF). web.archive.org. 2016-03-03 [2020-01-03].
- (PDF). web.archive.org. 2016-03-03 [2020-01-03].
外部連結
- 元素铋在洛斯阿拉莫斯国家实验室的介紹(英文)
- —— {{LinkForElement|Bi| }}(英文)
- 元素铋在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素铋在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – {{LinkForElement|Bi| }}(英文)