光學同調斷層掃描
光学相干断层扫描(英文: Optical coherence tomography,简称OCT)是一种光学信号获取与处理的方式。它可以对光学散射介质如生物组织等进行扫描,获得的三维图像分辨率可以达到微米级。光学相干断层扫描技术利用了光的干涉原理,通常采用近红外光进行拍照。由于选取的光线波长较长,可以穿过扫描介质的一定深度。另一种类似的技术,共焦显微技术,穿过样品的深度不如光学相干断层扫描。

光学相干断层扫描使用的光源包括超辐射发光二极管与超短脉冲激光。根据光源性质的不同,这种扫描方式甚至可以达到亚微米级的分辨率,这时需要光源的频谱非常宽,波长的变化范围在100纳米左右。
光学相干断层扫描技术是光学断层扫描技术的一种。目前比较先进的一种光学相干断层扫描技术为频域光学相干断层扫描,这种扫描方式的信噪比较高,获得信号的速度也比较快。商用的光学相干断层扫描系统有多种应用,包括艺术品保存和诊断设备,尤其是在眼科中,这种断层扫描系统可以获取视网膜的细节图像。最近,这种技术也被用于心脏病学的研究,以对冠状动脉的疾病进行诊断 [1]。
简介

在全世界范围内,有数个研究组织从采用白光干涉对活体内人眼进行测量开始[2][3]对人体组织,尤其是眼睛的成像进行研究。1990年的 ICO-15 SAT 会议上,首先展示了一张基于白光干涉深度扫描原理的对活体内人眼眼底沿眼水平子午线的二维图像[4]。1990年,丹野直弘对这个方案进行了进一步的研究[5][6],随后日本山形大学的一位教授也对此展开了研究[7]。这些研究使得光学相干断层扫描技术拥有了微米级的分辨率和毫米级的穿透深度,还拥有产生截面图像的能力,因此它成为一种重要的生物组织成像技术[8]。1993年,首次采用光学相干断层扫描技术对活体内的视网膜结构成像[9][10] 。 光学相干断层扫描也被应用于许多艺术品保护的项目中,它被用来分析绘画作品的不同层次。与其他医学图像系统相比,光学相干断层扫描有很大的优势。医用超声成像和核磁共振成像由于分辨率不够,无法用于形态组织成像,而共焦显微技术则缺少毫米级的穿透能力[11][12]。
光学相干断层扫描是基于弱相干干涉学理论发展的[13][14][15]。在传统的干涉学中需要使用相干长度很长的光源,因此通常选用激光作为干涉光源,相干长度通常达到数米。而在光学相干断层扫描技术中,由于使用了宽带光源,相干长度被缩短到了几个微米。宽带光源通常可以使用超辐射发光二极管或超短脉冲的激光(飞秒激光器)来实现。白光也是一种功率较低的宽带光源。
光学相干断层扫描系统中的光束被分成两部分:一部分称为样品光臂,照射在样品上;一部分被称为参考光臂,通常照在镜子上。样品产生的反射光和参考光臂产生的反射光会发生干涉,而仅仅当两条光路的长度相同(差距小于相干长度)时,会产生稳定的干涉图样。通过调整参考光臂的镜子,可以得到样品的反射轮廓,这种技术被称为时域光学相干断层扫描。样品反射能力较强的区域会产生较强的干涉,而超出干涉长度的反射光将不会产生干涉。这样产生的反射轮廓被称为A扫描,包含有我们观察的样品内部结构的空间大小与位置的信息。截面断层扫描B扫描可以通过结合不同深度的A扫描结果来重建。根据使用的成像引擎的能力,还可以实现在给定深度上的C扫描。
原理
光学相干断层扫描可以获得透明或者不透明物质的表面以及次表面图像,图像的分辨率与小型显微镜相同。它可以认为是一种类似超声成像的光学技术,通过组织对光线的反射来提供截面图像。与其它成像技术相比,光学相干断层扫描可以提供拥有微米级分辨率的活体组织形态图像,因此,在医学界,它是一种非常具有吸引力的技术。
光学相干断层扫描的主要优点是
- 对活体组织成像,分辨率可达微米级
- 对组织形态迅速、直接的成像
- 不需要制备样品
- 不需要离子辐射
由于光学相干断层扫描采用了波长很短的光波作为探测手段,它可以达到很高的分辨率。首先将一束光波照在组织上,一小部分光被样品表面反射,然后被收集起来。大部分的光线被样品散射掉了,这些散射光失去了远视的方向信息,因此无法形成图像,只能形成耀斑。散射光形成的耀斑会引起光学散射物质(如生物组织、蜡、特定种类的塑料等等)看起来不透明或者透明,尽管他们并不是强烈吸收光的材料。采用光学相干断层扫描技术,散射光可以被滤除,因此可以消除耀斑的影响。即使仅仅有非常微小的反射光,也可以被采用显微镜的光学相干断层扫描设备检测到并形成图像。
光学相干是滤除散射光的物理机制。反射光可以作为相干光,而由于散射光散射的位置不同,造成光路长度的差异,再加上光源的相干长度极短,使得散射光失去了相干的性质。在光学相干断层扫描设备中,光学干涉仪被用来检测相干光。从原理上说,干涉仪可以将散射光从反射光中滤除,以得到生成图像的信号。在信号处理过程中,可以得到从某一次表面反射的反射光深度和强度。三维图像可以通过类似声纳和雷达的扫描来构建。
在已经引入医学研究的无创三维成像技术中,光学相干断层扫描技术与超声成像都采用了回波处理技术,因此他们的原理相似。其他的医学成像技术如计算机断层扫描、核磁共振成像以及正电子发射断层扫描都没有利用回声定位的原理。
光学相干断层扫描的局限性是仅能扫描生物组织表面下1-2毫米的深度。这是由于深度越大,光线无散射的射出表面的比例就越小,以至于无法检测到。但是在检测过程中不需要样品制备过程,成像过程也不需要接触被成像的组织。更重要的是,设备产生的激光是对人眼安全的近红外线,因此几乎不会对组织造成伤害。
理论细节
光学相干断层扫描的基础理论是白光或低相干光的干涉。在这种技术中,光学设备包括一个干涉仪(在图.1中,使用了典型的迈克耳孙干涉仪),和低相干的宽带光源。光线被分成两束,分别称为参考光臂和样品光臂,然后又将这两束光合并以产生干涉图样。
 图1. 全场相干断层扫描的光学设备。主要结构的名称:超辐射发光二极管(SLD),凸透镜(L1),50/50分光器(BS),照相机物镜(CO),CMOS-DSP照相机(CAM),参考平面(REF)和样品(SMP)。照相机的功能是一个二维探测器阵列。当该设备对深度扫描的时候,可以以无损的方式重建样品的三维图像。 |

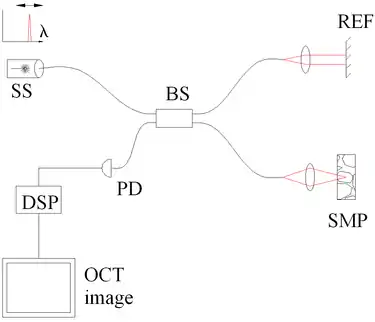 图3. 采用光源扫频相干断层扫描技术来鉴别频谱。主要结构名称:扫频光源或可调激光器(SS),分光器(BS),参考镜面(REF),样品(SMP),光子探测器(PD)以及数字信号处理模块(DSP)。 |
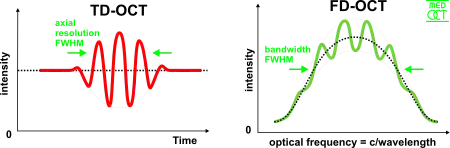
时域光学相干断层扫描
在时域光学相干断层扫描中,参考光臂的光路长度可以转换为时间。低相干光源干涉的一个重要特征是相干图样,也就是明暗相间的条纹,仅当光路的长度差小于光源的相干长度时才会发生。这种干涉称为对称干涉仪中的自相关(两个光臂具有相同的反射性)。在光路长度差发生变化的时候,调制的包络也发生改变,而包络的峰值对应着光路的匹配。
两束部分相干的光线的干涉可以用光强的变化来表达
其中,代表光强,表示相干光线分离比例,被称为相干度,这个函数是一个复数,它是依赖于参考光臂扫描(时间延迟)的干涉的包络与载波的比例。在光学相干断层扫描中,主要的工作就是计算相干度的大小。由于相干的门控效应,相干度可以表示为一个高斯函数[15]
其中,表示光源的频谱宽度,是光源的中心频率。在等式(2)中,高斯函数包络是光载波调制后的幅度,包络的峰值表示样品被测试的微结构的位置,而幅度则依赖于样品表面的反射性。光载波的频率会受到扫描时干涉仪的光臂移动而产生多普勒效应,其频率可以由扫描的速度来控制。这样,干涉仪臂的移动有两个作用,通过改变光路长度来实现深度扫描和带有多普勒频移的光载波。在光学相干断层扫描中,多普勒频移可以表达为
其中 为光源的中心频率,为光路变化的扫描速度,而 代表光速。
光学干涉断层扫描的轴向和侧向分辨率是彼此独立的;前者是光源的相干长度,而后者是光学的函数。光源的相干长度,也就是断层扫描的轴向分辨率为
频域光学相干断层扫描
在频域光学相干断层扫描中,宽带干涉的信号通过频域分离的探测器来获取,分离的方式可以通过使用可变频率光源在不同时刻的频率的时间编码或者使用如光栅和线性探测器阵列的色散探测器。根据傅立叶变换中的维纳-辛钦定理,信号的自相关函数与其功率谱密度互为傅立叶变换对,因此深度扫描可以通过对获得的频谱进行傅立叶变换立即得到,而不必移动参考光臂[16][17]。这个特点可以极大提高成像的速度,而且可以增强信噪比。然而对多种波长的并行检测限制了扫描的范围,光源的频谱宽度也限定了轴向的分辨率。
空间编码频域光学相干断层扫描
空间编码的频域光学相干断层扫描通过将不同光学频率的光线分散透射在探测器阵列上来提取空间信息(参见图4)。这样,仅仅通过一次照射就可完成一次对深度的扫描。虽然理论上空间编码频域扫描所获取的信号信噪比较高,但由于探测器的动态范围与光敏二极管相比较小,会造成信噪比的损失。在使用1300纳米波长工作的时候,由于在这个波长区域动态范围的问题并不严重,因此信噪比的损失尚可接受。
这种方法的缺点是信噪比会出现严重下降的情况,信噪比的下降和零延迟的距离成正比。由于探测器的波长受限,信噪比依赖于深度以sinc函数的形式衰减。这是由于一个像素其实探测到的是光学频谱区域的一段,而不是单一的频率,对其进行傅立叶变换就会产生sinc函数。另外,频谱探测器中的色散元件一般也无法将光线依其频率线性投射在探测器上,而通常是按照频率的倒数投射,这种非线性效应会进一步的降低信号的质量。但是随着具有更多像素的新一代的CCD元件或光敏二极管阵列,信噪比的下降并不是一个严重的问题。此外,合成阵列外差检测可以作为解决这一问题的另一个手段,而不需要使用高色散的元件。
时间编码频域光学相干断层扫描
时间编码频域光学相干断层扫描试图将时域扫描和空间编码频域扫描的优点结合起来。在这种技术中,频谱中的不同成分不是在空间上区分的而是在时间上区分。通过滤波或者调节生成波的频率可以产生连续频率的光波,而频谱可以在进行傅立叶变换之前重建出来。通过使用扫频光源(例如频率扫描激光),采用的光学设备会比空间编码频域扫描的方式更简单,如图3所示,而扫描的问题则由光源频率的变化来解决。这种扫描方法的主要优势是可以提供高信噪比的信号,而扫频激光光源的瞬时带宽很小,通常只有20千赫-200千赫,它的缺点则是波长的非线性,这个问题在扫描频率较高的时候尤其严重。在高频率下的带宽展宽会使其对扫描时的运动或样品的运动高度敏感。
扫描方式
将光线聚集在待测样品表面上,并将反射光与参考光混合会产生关于样品信息的干涉图样,这个干涉图样对应于简单的A扫描,因为它仅仅扫描了Z轴。对样品的扫描可以通过移动照射在样品上的光线或者移动样品来实现。线式扫描会产生一个二维的数据集,对应于样品的一个截面(X-Z轴扫描),而面积扫描会得到三维数据集,对应于一个立体的图像(X-Y-Z轴扫描),这也被称为全场光学相干断层扫描。
单点(共焦)光学相干断层扫描
基于单点光学相干断层扫描的系统必须对样品从两个维度进行扫描,然后使用扫描时通过参考光臂轴向扫描的相干门控效应所得到的深度信息来重建三维图像。二维的侧面扫描通过使用电子机械手段移动样品来实现[17] 。这种电子机械系统一般使用一个平移平台和一个微机电扫描系统[18]。
应用场合
光学相干断层扫描是一种已经成熟的医学成像技术。它被广泛的应用于获得视网膜和眼前段的高分辨率图像,可以提供直接评估多发性硬化中的轴突完整性的手段[24]。研究人员还试图寻找一种利用频域光学相干断层扫描技术来拍摄冠状动脉的方法,以检测脆弱的富脂斑块。
光学相干断层扫描也被广泛的应用于工业界,如无损检测、材料厚度测量、表面粗糙度测量、表面和截面成像[25] 以及体积损耗测量。带有反馈的光学相干断层扫描系统可以用于控制制造过程。由于获取速度高和其微米级的分辨率,光学断层扫描可以在线上或者离线运行。基于光纤的光学断层扫描更加适用于工业环境。它们可以进入并扫描通常手段难于进入的空间内部[26] ,也可以在有害的环境中进行操作,例如放射性环境、低温高温环境等场合[27]。
另见
- 干涉
- 干涉仪
- 断层扫描
- 角分辨低相干干涉
- 弹道光子
- 光学外差检测
参考文献
- Hiram G. Bezerra, MD, PhD*, Marco A. Costa, MD, PhD*,*, Giulio Guagliumi, MD, Andrew M. Rollins, PhD, Daniel I. Simon, MD*. "Intracoronary Optical Coherence Tomography: A Comprehensive Review: Clinical and Research Applications". JACC Cardiological Interventions . VOL. 2, NO. 11, 2009 p.1035-1046. Web. http://interventions.onlinejacc.org/cgi/reprint/2/11/1035 页面存档备份,存于.
- A. F. Fercher and E. Roth, “Ophthalmic laser interferometry. Proc. SPIE vol. 658, pp. 48-51. 1986.
- Fercher, AF; Mengedoht, K; Werner, W. . Optics letters. 1988, 13 (3): 186–8. PMID 19742022. doi:10.1364/OL.13.000186.
- A. F. Fercher, “Ophthalmic interferometry,” Proceedings of the International Conference on Optics in Life Sciences, Garmisch-Partenkirchen, Germany, 12–16 August 1990. Ed. G. von Bally and S. Khanna, pp. 221-228. ISBN 0-444-89860-3.
- Naohiro Tanno, Tsutomu Ichikawa, Akio Saeki: “Lightwave Reflection Measurement,” Japanese Patent # 2010042 (1990) (Japanese Language)
- Shinji Chiba, Naohiro Tanno “Backscattering Optical Heterodyne Tomography”, prepared for the 14th Laser Sensing Symposium (1991) (in Japanese)
- Huang, D; Swanson, EA; Lin, CP; Schuman, JS; Stinson, WG; Chang, W; Hee, MR; Flotte, T; Gregory, K. . Science. 1991, 254 (5035): 1178–81. PMID 1957169.
- Zysk, AM; Nguyen, FT; Oldenburg, AL; Marks, DL; Boppart, SA. . Journal of biomedical optics. 2007, 12 (5): 051403. PMID 17994864. doi:10.1117/1.2793736.
- A. F. Fercher, C. K. Hitzenberger, W. Drexler, G. Kamp, and H. Sattmann, “ In Vivo Optical Coherence Tomography,” Am. J. Ophthalmol., vol. 116, no. 1, pp. 113-114. 1993.
- Swanson, E. A.; Izatt, J. A.; Hee, M. R.; Huang, D.; Lin, C. P.; Schuman, J. S.; Puliafito, C. A.; Fujimoto, J. G. . Optics Letters. 1993, 18 (21): 1864. PMID 19829430. doi:10.1364/OL.18.001864.
- Drexler, Wolfgang; Morgner, Uwe; Ghanta, Ravi K.; Kärtner, Franz X.; Schuman, Joel S.; Fujimoto, James G. . Nature Medicine. 2001, 7 (4): 502. PMC 1950821. PMID 11283681. doi:10.1038/86589.
- Kaufman, S; Musch, DC; Belin, MW; Cohen, EJ; Meisler, DM; Reinhart, WJ; Udell, IJ; Van Meter, WS. . Ophthalmology. 2004, 111 (2): 396. PMID 15019397. doi:10.1016/j.ophtha.2003.12.002.
- Riederer, S.J. . IEEE Engineering in Medicine and Biology Magazine. 2000, 19: 34. doi:10.1109/51.870229.
- M. Born and E. Wolf. . Cambridge University Press. 2000. ISBN 0521784492.
- Fercher, A. F.; Mengedoht, K.; Werner, W. . Optics Letters. 1988, 13 (3): 186. PMID 19742022. doi:10.1364/OL.13.000186.
- Schmitt, J.M. . IEEE Journal of Selected Topics in Quantum Electronics. 1999, 5: 1205. doi:10.1109/2944.796348.
- Fercher, A. . Optics Communications. 1995, 117: 43. doi:10.1016/0030-4018(95)00119-S.
- . Sensors and Actuators A: Physical. 2005, 117: 331. doi:10.1016/j.sna.2004.06.021.
- Dunsby, C; Gu, Y; French, P. . Optics express. 2003, 11 (2): 105–15. PMID 19461712. doi:10.1364/OE.11.000105.
- Roy, M. . Optics and Lasers in Engineering. 2002, 37: 631. doi:10.1016/S0143-8166(01)00146-4.
- Akiba, M.; Chan, K. P.; Tanno, N. . Optics Letters. 2003, 28 (10): 816. PMID 12779156. doi:10.1364/OL.28.000816.
- Dubois, A; Vabre, L; Boccara, AC; Beaurepaire, E. . Applied optics. 2002, 41 (4): 805–12. PMID 11993929. doi:10.1364/AO.41.000805.
- Bourquin, S.; Seitz, P.; Salathé, R. P. . Optics Letters. 2001, 26 (8): 512. PMID 18040369. doi:10.1364/OL.26.000512.
- Saidha S, Eckstein C, and Ratchford JN. (2010). "Optical Coherence Tomography for the Detection of Axonal Damage in Multiple Sclerosis 页面存档备份,存于". CML – Ophthalmology 2010;20(3):77–88.
- Guss, G.; Bass, I.; Hackel, R.; Mailhiot, C.; Demos, S.G. (PDF). Lawrence Livermore National Laboratory UCRL-PROC-236270. November 6, 2007 [December 14, 2010]. (原始内容 (PDF)存档于2017-02-11).
- Dufour, Marc; Lamouche, G.; Gauthier, B.; Padioleau, C.; Monchalin, J.P. (PDF). SPIE - The International Society for Optical Engineering. 2006 [December 15, 2010]. doi:10.1117/2.1200610.0467. (原始内容存档 (PDF)于2012-10-23).
- Dufour, M. L.; Lamouche, G.; Detalle, V.; Gauthier, B.; Sammut, P. (PDF). Industrial Materials Institute, National Research Council (Canada). 2004 [December 20, 2010]. doi:10.1.1.159.5249 请检查
|doi=值 (帮助). (原始内容存档 (PDF)于2011-09-27).
