支原體屬
支原体是一类无细胞壁结构、介于独立生活和细胞内寄生生活之间的最小的原核生物。许多种类可使人和动物致病,有些腐生种类生活在土壤、污水和堆肥中[1]。屬厚壁菌門柔膜菌綱,可以在培养基上形成极小的菌落。由於不具細胞壁,許多常見的抗生素,如盤尼西林或Β-内酰胺类抗生素對支原體是無效的。許多種類的支原體可導致疾病,如肺炎支原體,是某些非典型肺炎與其他呼吸疾病的病原體。生殖道支原体則會引起骨盆腔發炎。
| Mycoplasmosis | |
|---|---|
| 分类和外部资源 | |
| ICD-10 | A49.3 |
| ICD-9-CM | 041.81 |
| 支原体属 | |
|---|---|
 | |
| 科学分类 | |
| 界: | 原核生物界 Bacteria |
| 门: | 軟壁菌門 Tenericutes |
| 纲: | 柔膜菌纲 Mollicutes |
| 目: | 支原体目 Mycoplasmatales |
| 科: | 支原体科 Mycoplasmataceae |
| 属: | 支原体属 Mycoplasma Nowak, 1929 |
| 種 | |
|
鸡毒支原体 M. gallisepticum | |
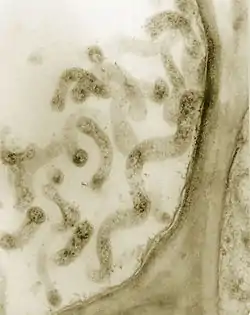
支原体少数可以自由生活在静水中,但多数存在于人类与动物的消化道、呼吸道和泌尿生殖道中,可导致疾病。有的支原体可导致植物病害。
特徵
目前已發現的支原體超過一百多種,屬於柔膜菌綱。柔膜菌綱寄生於人類與其他動植物身上(包括昆蟲),但也可形成偏利共生。膽固醇是支原體以及其他柔膜菌綱菌種生存的必要條件。支原體最理想的生存溫度是宿主的體溫,或是宿主喪失調控自體溫度的機能時的外部環境溫度。透過16S核糖體RNA序列與基因的分析指出,柔膜菌綱(包括支原體在內)非常接近乳酸桿菌與梭狀芽胞桿菌。
細胞結構
支原體及其相近菌種都缺乏細胞壁,但菌體卻能保持一定形狀。細胞的特定形狀可能使支原體能夠在不同的環境中自我繁殖。
例如,肺炎支原體從自身粒狀體細胞延伸出「尖端結構」,能夠附著於宿主細胞,也能幫助在固體表面滑行,此外在細胞分裂過程中也扮演重要的角色。肺炎支原體非常微小,形狀也很多種,但大致上像縱切的圓底燒瓶。
支原體在所有細菌中獨樹一格,需要固醇才能維持細胞膜的穩定。支原體所需的固醇來自外部環境,通常是動物宿主。支原體的基因組一般只有0.58-1.38百萬鹼基,使得它的生物合成能力薄弱,必須依賴宿主才能進行合成。此外支原體遺傳密碼中的密碼子UGA能夠編譯成色胺酸,而不是一般的乳白色終止碼。
染色特征
因其无细胞壁,故呈革兰氏阴性,且形态容易变化,对渗透压较为敏感,对抑制细胞壁合成的抗生素不敏感。
菌落特征
菌落较小(直径0.1~1.0毫米),其在固体培养基表面呈现特有的“油煎蛋”形。
繁殖方式
以二分裂或出芽等常见的方式进行繁殖。
药物耐受性
因无细胞壁,所以对beta lactam類(ex.青霉素 etc.)與glycopeptides類等等破坏细胞壁类药物不敏感,但对能抑制蛋白质生物合成的抗生素,如红霉素、四环素等,以及破坏含有甾体结构的细胞膜结构的抗生素(如两性霉素、制霉菌素等等)非常敏感。但此類中的人黴漿菌(Mycoplasma hominis)對於巨環類黴素(ex.紅黴素 etc.)具備天然抗性。
基因组较小
支原体的遗传基因组很小,仅在0.6~1.1Mb左右,约为大肠杆菌的1/4~1/5。肺炎支原體的基因组只有0.81Mb。生殖道支原体的基因组更小,只有0.58Mb,470个基因。
菌落培養
1898年,諾卡德(Nocard)與儒克斯(Roux)兩人培養了引起傳染性胸膜性肺炎(CBPP)的細菌,該種細菌在當時造成了牛隻嚴重的大規模感染[2][3]。傳染性胸膜性肺炎由絲狀黴漿菌中的絲狀生物型小菌落(SC)所引起,而諾卡德與儒克斯是歷史上首次培養黴漿菌的人。然而由於黴漿菌複雜的生長條件,菌體的培養至今仍困難重重。
微小的基因組
近來拜分子生物學與基因組學的進步所賜,基因構造簡單的黴漿菌,尤其是肺炎黴漿菌及其近親生殖道黴漿菌,已引起了較為廣大的注意。科學家發表了生殖道黴漿菌完整的基因組序列,指出該菌種是擁有最小基因組的生物體之一,能夠獨立存在[4]。稍後肺炎黴漿菌的基因組序列也得到了發表。肺炎黴漿菌是基因定序史上首次以引物步移法對黏質體資料庫進行定序,而非以傳統的霰彈槍定序法[5]。科學家在基因組學及蛋白質組學持續研究黴漿菌,試圖了解所謂的辛西婭人工生命[6]、編目完整的細胞蛋白質結構[7],並繼續利用這些生物體微小基因組的優勢來進行浩如煙海的生物學研究。
分類
- 柔膜菌纲
- 支原体目
- 支原体科
- 支原体属
- 支原体科
- 支原体目
参考文献
- 周德庆. 吴雪梅 , 编. 第二版. 北京: 高等教育出版社. 2002年5月: 45–46. ISBN 7040111160.
- Nocard, E.I.E. & Roux, E.; Le microbe de la péripneumonie. Ann Inst Pasteur 12, 240-262. (Translated as ‘The microbe of pleuropneumonia’ in Rev Infect Dis 12, 354-358 (1990))
- Hayflick L. & Chanock, R.M. (PDF). Bacteriol. Reviews. 1965, 29 (2): 185–221 [2010-10-24]. (原始内容存档 (PDF)于2011-06-11).
- Fraser CM, Gocayne JD, White O; 等. . Science (journal). October 1995, 270 (5235): 397–403. PMID 7569993.
- Himmelreich R, Hilbert H, Plagens H, Pirkl E, Li BC, Herrmann R. . Nucleic Acids Res. November 1996, 24 (22): 4420–49. PMC 146264. PMID 8948633. doi:10.1093/nar/24.22.4420.
- Hutchison CA, Montague MG. . . New York: Kluwer Academic/Plenum. 2002: 221–54. ISBN 0306472872.
- Regula JT, Ueberle B, Boguth G; 等. . Electrophoresis. November 2000, 21 (17): 3765–80. PMID 11271496. doi:10.1002/1522-2683(200011)21:17<3765::AID-ELPS3765>3.0.CO;2-6.
8. Lee JY, Yang JS. 2020. Prevalence and antimicrobial susceptibility of Mycoplasma hominis and Ureaplasma species in nonpregnant female patients in South Korea indicate an increasing trend of pristinamycin-resistant isolates. Antimicrob Agents Chemother 64:e01065-20. https://doi.org/10.1128/AAC.01065-20.
外部連結
參見
- 支原体感染
- 細菌分類表