结合位点
在生物化学和分子生物学中,结合位点是大分子(如蛋白质)上的一个区域,它与另一个具有特异性的分子结合。[1]大分子的结合伙伴通常被称为配体。[2]配体可以包括其他蛋白质(导致蛋白质交互作用)[3]、酶底物[4]、第二信使、激素或变构调节剂[5]。结合事件经常,但并不总是伴随着构象变化,从而改变蛋白质的功能。[6]与蛋白质结合位点的结合通常是可逆的(瞬时和非共价),但也可以是共价可逆[7]或不可逆的[8]。
功能
配体与蛋白质结合部位的结合常常引起蛋白质构象的改变,并导致细胞功能的改变。因此,蛋白质上的结合位点是信号转导途径的关键部分。[9] 配体的种类包括神经递质、毒素、神经肽和类固醇激素。[10]结合位点在许多情况下引起功能改变,包括酶催化、分子途径信号、稳态调节和生理功能。电荷、空间形状和位点的几何结构选择性地允许高特异性配体结合,激活蛋白质所负责的细胞相互作用的特定级联。[11][12]
催化作用
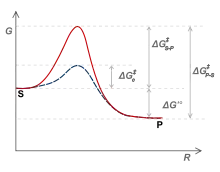
酶通过比底物和产物更强烈地与过渡态结合而产生催化作用。在催化结合位点,许多不同的相互作用可能作用于底物。包括电催化、酸碱催化、共价催化和金属离子催化。[10]这些相互作用通过提供有利于稳定高能分子的相互作用来降低化学反应的活化能。酶结合允许更接近反应物,排除与反应无关的物质。这种特殊的结合也阻止了副反应的发生。[13][10]
可以执行这些作用的酶的类型包括氧化还原酶、转移酶、水解酶、裂解酶、异构酶和连接酶。[14]
例如,转移酶己糖激酶催化葡萄糖磷酸化生成葡萄糖-6-磷酸。己糖激酶的活性位点残基允许活性位点中的葡萄糖分子稳定,并刺激有利相互作用的替代途径的启动,降低活化能。[15]
抑制
通过抑制剂结合抑制蛋白质可能导致通路调节、稳态调节和生理功能的障碍。
竞争性抑制剂与底物竞争,在活性部位与游离酶结合,从而在结合时阻碍酶-底物复合物的产生。例如,一氧化碳中毒是由血红蛋白中的一氧化碳的竞争性结合阻止氧结合引起的。
非竞争性抑制剂,与此不同,与活性部位的底物同时结合。与酶-底物(ES)复合物结合后,形成酶-底物-抑制剂(ESI)复合物。与竞争性抑制剂类似,产物形成速率也降低。[4]
混合抑制剂能够结合自由酶和酶-底物复合物。然而,与竞争性和非竞争性抑制剂相比,混合抑制剂与变构位点结合。变构结合诱导构象变化,可能增加蛋白质对底物的亲和力。这种现象称为正极性调制。相反,降低蛋白质与底物亲和力的变构结合是负极性调制。[16]
种类
活性位点
在活性部位,一种底物与一种酶结合以诱导化学反应。[17][18]底物、过渡态和产物可以与活性位点以及任何竞争性抑制剂结合。[17]例如,在蛋白质功能方面,肌肉细胞中钙与肌钙蛋白的结合可以诱导肌钙蛋白的构象变化。这使得原肌球蛋白暴露肌动蛋白-肌球蛋白结合位点,肌球蛋白头部结合形成一个交联桥并诱导肌肉收缩。[19]
在血液中竞争结合的一个例子是一氧化碳,它在血红素的活性部位与氧竞争。一氧化碳的高亲和力可能在低氧浓度下超过氧气。在这些情况下,一氧化碳的结合引起构象变化,阻碍血红素与氧结合,导致一氧化碳中毒。[4]

变构位点
在调节位点,配体的结合可能引起蛋白质功能的放大或抑制。[4][20]配体与多聚酶变构位点的结合通常会引起正的协同作用,即一种底物的结合会引起有利的构象变化,并增加酶与第二种底物结合的可能性。[21]调节位点配体包括homotropic和heterotropic,其中单个或多类分子分别影响酶活性。 [22]
在代谢途径中,受高度调控的酶通常是必不可少的。例如,磷酸果糖激酶(PFK)在糖酵解中磷酸化果糖,主要由ATP调节。它在糖酵解中的调节是必需的,因为它是该途径的速控步骤。PFK还通过异化代谢途径控制指定形成ATP的葡萄糖量。因此,在足够的ATP水平下,PFK被ATP变构抑制。这种调节有效地保存葡萄糖储备,而葡萄糖储备可能是其他代谢途径所需要的。柠檬酸盐是柠檬酸循环的中间产物,也是PFK的变构调节剂。[22][23]
结合曲线
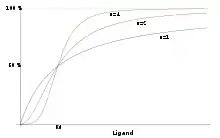
结合曲线描述配体与蛋白质的结合行为。曲线的特征可以是其形状,S形或双曲线,它们分别反映了蛋白质是否表现出协同或非协同的结合行为。[24]典型地,X轴描述配体的浓度,Y轴描述结合到所有可用结合位点的配体的饱和分数。[4]在确定曲线形状时,通常使用Michaelis-Menten方程。根据稳态条件导出Michaelis-Menten方程,并解释了酶在溶液中的反应。然而,当反应发生时,酶与底物结合的动力学表现不同。 [25]
当评估氧与血液中血红蛋白和肌红蛋白的结合亲和力时,用结合曲线建模是有用的。血红蛋白有四个血红素基团,表现出协同结合。这意味着氧与血红蛋白上血红素基团的结合诱导有利的构象变化,从而增加氧对下一血红素基团的结合有利性。在这种情况下,血红蛋白的结合曲线将是乙状结肠,因为它增加了对氧的结合有利性。由于肌红蛋白只有一个血红素基团,所以在结合曲线上呈现双曲线的非协同结合。[26]
应用
不同生物和人类之间的生化差异对药物开发很有用。例如,青霉素通过抑制DD转肽酶、破坏细菌细胞壁的发育和诱导细胞死亡来使细菌酶失活。因此,结合位点的研究涉及到许多领域的研究,包括癌症机制[27]、药物配方[28]和生理调节[29]。抑制蛋白功能的抑制剂的配方是药物治疗的一种常见形式。[30]
在癌症领域,被编辑成具有与天然配体相似外观的配体被用来抑制肿瘤生长。例如,化疗药物甲氨蝶呤在二氢叶酸还原酶活性部位起竞争性抑制剂的作用。[31]这种相互作用抑制了四氢叶酸的合成,阻断了DNA、RNA和蛋白质的产生。[31]抑制这种功能抑制肿瘤生长,改善严重银屑病和成人类风湿关节炎。[30]
在心血管疾病中,β受体阻滞剂等药物被用来治疗高血压患者。β受体阻滞剂(β受体阻滞剂)是一种抗高血压药物,能阻断肾上腺素和去甲肾上腺素与心脏和血管中β1和β2受体的结合。这些受体通常介导交感神经的“战斗或逃跑”反应,导致血管收缩。[32]
竞争性抑制剂在商业上也大量应用。肉毒杆菌毒素,商业上称为保妥适,是一种神经毒素,由于与乙酰胆碱依赖的神经结合而导致肌肉松弛性麻痹。这种相互作用抑制了肌肉收缩,呈现出平滑肌的外观。[33]
预测
已经开发了许多计算工具来预测蛋白质上结合位点的位置。[20][34][35]它们可以大致分为基于序列的或基于结构的。[35]基于序列的方法依赖于这样一个假设:蛋白质功能保守部分(如结合位点)的序列是保守的。 基于结构的方法需要蛋白质的三维结构。这些方法又可以细分为基于模板和基于容器的方法。[35]基于模板的方法寻找目标蛋白和具有已知结合位点的蛋白质之间的三维相似性。基于容器的方法在目标蛋白中寻找凹面或埋入容器,这些凹面或埋入容器具有疏水性和能形成氢键等特征,使得它们能够以高亲和力结合配体。[35] 即使这里使用的是容器(pocket)一词,类似的方法也可以用来预测蛋白质-蛋白质相互作用中使用的结合位点,这些结合位点通常更为平坦,而不是在容器中。[36]
参考文献
- . Medical Subject Headings (MeSH). U.S. National Library of Medicine. [2020-02-02]. (原始内容存档于2020-06-17).
The parts of a macromolecule that directly participate in its specific combination with another molecule.
- . Medical Subject Headings (MeSH). U.S. National Library of Medicine. [2020-02-02]. (原始内容存档于2020-06-17).
A molecule that binds to another molecule, used especially to refer to a small molecule that binds specifically to a larger molecule.
- Amos-Binks A, Patulea C, Pitre S, Schoenrock A, Gui Y, Green JR, Golshani A, Dehne F. . BMC Bioinformatics. June 2011, 12: 225. PMC 3120708. PMID 21635751. doi:10.1186/1471-2105-12-225.
- Hardin CC, Knopp JA. . . New York: Oxford University Press. 2013: 51–69. ISBN 978-1-62870-176-0.
- Kenakin TP. . Bowery NG (编). . CRC Press. April 2016: 26 [2020-02-02]. ISBN 978-1-4200-1618-5. (原始内容存档于2020-06-17).
- Spitzer R, Cleves AE, Varela R, Jain AN. . Proteins. April 2014, 82 (4): 679–94. PMC 3949165. PMID 24166661. doi:10.1002/prot.24450.
- Bandyopadhyay A, Gao J. . Current Opinion in Chemical Biology. October 2016, 34: 110–116. PMC 5107367. PMID 27599186. doi:10.1016/j.cbpa.2016.08.011.
- Bellelli A, Carey J. . . John Wiley & Sons. January 2018: 278 [2020-02-02]. ISBN 978-1-119-23848-5. (原始内容存档于2020-06-17).
- Xu D, Jalal SI, Sledge GW, Meroueh SO. . Molecular BioSystems. October 2016, 12 (10): 3067–87. PMC 5030169. PMID 27452673. doi:10.1039/c6mb00231e.
- Wilson K. . Cambridge University Press. March 2010: 581–624. ISBN 9780511841477. doi:10.1017/cbo9780511841477.016.
- Ahern K. . Oregon State University. 2015: 110–141.
- Kumar AP, Lukman S. . PLOS ONE. 2018-06-06, 13 (6): e0198632. PMC 5991966. PMID 29874286. doi:10.1371/journal.pone.0198632.
- Dobson CM, Gerrard JA, Pratt AJ. . Oxford University Press. 2008. ISBN 9780199248995. OCLC 487962823.
- Azzaroni O, Szleifer I. . 2017-12-04. ISBN 978-1-119-45501-1. doi:10.1002/9781119455042.
- . International Food Information Service. 2009. ISBN 978-1-4051-8740-4.
- Clarke KG. . Woodhead Publishing. 2013: 79–84. ISBN 978-1-78242-167-2. doi:10.1533/9781782421689.
- Wilson K. . . Cambridge University Press. March 2010: 581–624 [2018-11-01]. ISBN 9780511841477. doi:10.1017/cbo9780511841477.016. (原始内容存档于2018-12-15) (英语).
- Schaschke C. . Oxford University Press. 2014. ISBN 978-1-62870-844-8.
- Morris J. . United States of America: W.H. Freeman and Company. 2016: 787–792. ISBN 978-1-4641-2609-3.
- Konc J, Janežič D. . Current Opinion in Structural Biology. April 2014, 25: 34–9. PMID 24878342. doi:10.1016/j.sbi.2013.11.012.
- Fuqua C, White D. . Cell Signalling in Prokaryotes and Lower Metazoa (Springer Netherlands). 2004: 27–71. ISBN 9789048164837. doi:10.1007/978-94-017-0998-9_2.
- Creighton TE. . Helvetian Press. 2010. ISBN 978-0956478115. OCLC 760830351.
- Currell BR, van Dam-Mieras MC. . Oxford: Butterworth-Heinemann. 1997: 125–128. ISBN 978-0-7506-0561-8.
- Ahern K. . Biochemistry and Molecular Biology Education. January 2017, 45 (1): 25–30. PMID 27228905. doi:10.1002/bmb.20979.
- Anne A, Demaille C. . Langmuir. October 2012, 28 (41): 14665–71. PMID 22978617. doi:10.1021/la3030827.
- Morris JR, Hartl DL, Knoll AH. Second. New York, NY. ISBN 9781464126093. OCLC 937824456.
- Spitzer R, Cleves AE, Varela R, Jain AN. . Proteins. April 2014, 82 (4): 679–94. PMC 3949165. PMID 24166661. doi:10.1002/prot.24450.
- Peng J, Li XP. . Prostaglandins & Other Lipid Mediators. November 2018, 139: 87–92. PMID 30352313. doi:10.1016/j.prostaglandins.2018.10.004.
- McNamara JW, Sadayappan S. . Archives of Biochemistry and Biophysics. December 2018, 660: 121–128. PMC 6289839. PMID 30339776. doi:10.1016/j.abb.2018.10.007.
- Widemann BC, Adamson PC. . The Oncologist. June 2006, 11 (6): 694–703. PMID 16794248. doi:10.1634/theoncologist.11-6-694.
- Rajagopalan PT, Zhang Z, McCourt L, Dwyer M, Benkovic SJ, Hammes GG. . Proceedings of the National Academy of Sciences of the United States of America. October 2002, 99 (21): 13481–6. PMC 129699. PMID 12359872. doi:10.1073/pnas.172501499.
- Frishman WH, Cheng-Lai A, Chen J (编). . 2000. ISBN 978-1-57340-135-7. doi:10.1007/978-1-4615-6767-7.
- Montecucco C, Molgó J. . Current Opinion in Pharmacology. June 2005, 5 (3): 274–9. PMID 15907915. doi:10.1016/j.coph.2004.12.006.
- Roche DB, Brackenridge DA, McGuffin LJ. . International Journal of Molecular Sciences. December 2015, 16 (12): 29829–42. PMC 4691145. PMID 26694353. doi:10.3390/ijms161226202.
- Broomhead NK, Soliman ME. . Cell Biochemistry and Biophysics. March 2017, 75 (1): 15–23. PMID 27796788. doi:10.1007/s12013-016-0769-y.
- Jones, S.; Thornton, J. M. . Journal of Molecular Biology. 1997-09-12, 272 (1): 121–132. ISSN 0022-2836. PMID 9299342. doi:10.1006/jmbi.1997.1234.
外部链接
- MeSH(醫學主題詞)上面的Sites Binding Sites(美式英语)
- Drawing the active site of an enzyme
