亚铁氰化钾
亚铁氰化钾,俗称黄血盐,是化学式为K4[Fe(CN)6]·3H2O的配位化合物。室温下为柠檬黄色单斜晶体,于沸点分解。它不溶于乙醇,但在水中的溶解度高达300g/L。
| 亚铁氰化钾 | |
|---|---|
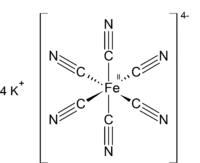 | |
 | |
| IUPAC名 Potassium hexacyanoferrate(II) | |
| 别名 | 黄血盐、亚铁氰酸钾、六氰合铁(II)酸钾[1] |
| 识别 | |
| CAS号 | 13943-58-3(无水) 14459-95-1(三水) |
| PubChem | 161067 |
| 性质 | |
| 化学式 | C6N6FeK4 |
| 摩尔质量 | (三水)422.39 g·mol⁻¹ |
| 外观 | 黄色晶体 |
| 密度 | 1.85 g/cm3 (固) |
| 熔点 | 70 °C ,343 K |
| 沸点 | 分解 |
| 溶解性(水) | 28.9 g/100 mL (水, 20° C) |
| 结构 | |
| 晶体结构 | 单斜 |
| 相关物质 | |
| 其他阴离子 | 铁氰化钾 |
| 附加数据页 | |
| 结构和属性 | 折射率、介電係數等 |
| 热力学数据 | 相變数据、固、液、气性质 |
| 光谱数据 | UV-Vis、IR、NMR、MS等 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
亚铁氰化钾水溶液与酸反应放出极毒的氰化氢(HCN)气体,但亚铁氰化钾自身毒性很低。[2]
亚铁氰化钾加热分解得到氰化钾,与三价铁离子反应生成颜料普鲁士蓝。
需要指出的是,亚铁氰化钾属于欧盟批准使用的食品添加剂(抗结块剂之列),在95/2/EC指令[3]中规定最高允许用量为20mg/kg(以无水亚铁氰化钾计)。
化学性质
热不稳定性
亚铁氰化钾对热不稳定,受热分解[4]:
- 3 K4[Fe(CN)6] —灼烧→ 12 KCN + Fe3C + 2 (CN)2↑ + N2↑ + C
- K4[Fe(CN)6] —△→ 4 KCN + FeC2 + N2↑
除了以上分解方式之外,亚铁氰酸钾根据分解的条件不同,还会产生Fe3C、Fe、C等純物質。在氧气中則分解产生氧化态产物,如Fe3O4、KFeO2等。[5]
还原性
亚铁氰化钾可以被氯气氧化[4]:
- 2 K4[Fe(CN)6] + Cl2 → 2 K3[Fe(CN)6] + 2 KCl
- 2 K4[Fe(CN)6] + 2 H2O + 13 Cl2(过量)→ 2 HCN + 10 CNCl + 8 KCl + 2 FeCl3 + 2 HClO
亚铁氰化钾也可以被过氧化氢氧化[4]:
- 2 K4[Fe(CN)6] + H2O2 → 2 K3[Fe(CN)6] + 2 KOH
- 2 K4[Fe(CN)6] + H2O2 + 2 HCl → 2 K3[Fe(CN)6] + 2 KCl + 2 H2O
和酸反应
- K4[Fe(CN)6](浓) + 4 HCl → H4[Fe(CN)6] + 4 KCl
和硫酸反应的产物则取决于硫酸的浓度、具体反应条件等:
- 2 K4[Fe(CN)6] + 6 H2SO4(稀、沸) → 6 KHSO4 + K2Fe[Fe(CN)6]↓(白) + 6 HCN
- K4[Fe(CN)6] + 3 H2SO4(3:1稀) —共沸→ 6 HCN + FeSO4 + 2 K2SO4
- K4[Fe(CN)6] + 6 H2SO4(浓) + 6 H2O —共沸→ FeSO4 + 2 K2SO4 + 3 (NH4)2SO4 + 6 CO↑
- K4[Fe(CN)6] + 11 H2SO4(浓) + 6 H2O —共沸→ 6 NH4HSO4 + 4 KHSO4 + FeSO4 + 6 CO↑
- K4[Fe(CN)6] + 4 H2SO4(浓、缓慢加入) → 4 KHSO4 + H4[Fe(CN)6]
和氮的含氧酸反应:
- K4[Fe(CN)6] + HNO2 + CH3COOH → K3[Fe(CN)6] + CH3COOK + NO↑ + H2O
- 3 K4[Fe(CN)6] + 4 HNO3(浓) → K3[Fe(CN)6] + 3 KNO3 + NO↑ + 2 H2O
和碱土金属盐的反应
- K4[Fe(CN)6](冷、浓) + CaCl2 → K2Ca[Fe(CN)6] + 2KCl
- K4[Fe(CN)6] + 2CaCl2 → Ca2[Fe(CN)6]↓ + 4KCl
- K4[Fe(CN)6] + BaCl2 + 3H2O —煮沸→ K2Ba[Fe(CN)6]·3H2O + 2KCl
- K4[Fe(CN)6] + MgCl2 + 7H2O —煮沸→ K2Mg[Fe(CN)6]·7H2O↓ + 2KCl
和其他主族金属盐的反应
- K4[Fe(CN)6] + 2Pb(NO3)2 → Pb2[Fe(CN)6]↓(白色) + 4KNO3
和铁盐的反应
- 3K4[Fe(CN)6] + 4FeCl3 → Fe4[Fe(CN)6]3↓(普鲁士蓝)+ 12KCl
- 6K4[Fe(CN)6] + 6FeCl3(冷) → K6Fe6[Fe(CN)6]6(aq) + 18KCl
- 6K4[Fe(CN)6] + 8FeCl3 —△→ Fe8[Fe(CN)6]6↓ + 24KCl
- K4[Fe(CN)6] + 2FeCl2 → Fe2[Fe(CN)6]↓(白色) + 4KCl
- 6Fe2[Fe(CN)6] + 6H2O + 3O2 → 4Fe(OH)3 + 2Fe4[Fe(CN)6]3
- K4[Fe(CN)6] + Fe4[Fe(CN)6]3 → 4 KFe[Fe(CN)6]
- K4[Fe(CN)6] + Fe(OH)(NO3)2 → Fe(OH)3 + 2 FeK[Fe(CN)6] + 6 KNO3
和其他过渡金属盐的反应
- K4[Fe(CN)6] + 2CoCl2 → Co2[Fe(CN)6]↓(绿色) + 4KCl
- K4[Fe(CN)6] + 2CdCl2 → Cd2[Fe(CN)6]↓(白色) + 4KCl
- K4[Fe(CN)6](S) + HgCl2(S) —△→ (CN)2↑ + 4KCN + FeCl2 + Hg
- K4[Fe(CN)6] + 2AgI → Ag2I↓ + K3[Fe(CN)6] + KI
- K4[Fe(CN)6] + Th(NO3)4 → 4KNO3 + Th[Fe(CN)6]↓(白色)
- K4[Fe(CN)6] + TiCl4 → 4KCl + Ti[Fe(CN)6]↓(淡红棕色)
- K4[Fe(CN)6] + 2Cu(NO3)2 → Cu2[Fe(CN)6]↓(红褐色) + 4KNO3
- K4[Fe(CN)6] + 4AgNO3 → 4KNO3 + Ag4[Fe(CN)6]↓(白色)
- K4[Fe(CN)6] + 2 UO2Cl2 → (UO2)2[Fe(CN)6]↓(黑棕色) + 4 KCl
其他反应
亚铁氰化钾可以和碳酸钾在高温下反应:
- K4[Fe(CN)6] + K2CO3 → 5 KCN + KOCN + Fe + CO2↑
- 2 K4[Fe(CN)6] + 2 K2CO3 + 15 S → 12 KSCN + 2 FeS + SO2↑ + 2CO2↑
亚铁氰化钾和钼酸铵的盐酸溶液反应,可以得到棕色的亚铁氰酸钼沉淀。
参考资料
- . 2006-02-17 [2008-02-25]. (原始内容存档于2007-07-13).
- JT Baker, Inc. . 2006-02-13 [2008-02-25]. (原始内容存档于2008-02-29).
- (PDF). 1995-02-20 [2011-02-27]. (原始内容 (PDF)存档于2011-11-25).
- 《无机化学反应方程式手册》.曹忠良 王珍云 编.湖南科学技术出版社.第十三章 铁系元素. P344. 【K4[Fe(CN)6]】和【[Fe(CN)6]4-】
- J. I. Kunrath, C. S. Müller, E. Frank. . Journal of Thermal Analysis. 1978-12, 14 (3): 253–264 [2018-07-20]. ISSN 0022-5215. doi:10.1007/bf01915163 (英语).
- 《无机化学丛书》. 第九卷 锰分族 铁系 铂系. 谢高阳 等. 科学出版社. P191. Fe(II)的阴离子络合物
外部链接
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
