吡啶氯铬酸盐
吡啶氯铬酸盐,分子式C5H4N·HCrO3Cl,简称PCC,即pyridinium chlorochromate的缩写。一种温和的氧化剂,橙黄色晶体。用来把醇有限度地氧化为醛,使用PCC的缺點為反應時間太過冗長和PCC具有毒性。
| 吡啶氯铬酸盐 | |||
|---|---|---|---|
 | |||
| |||
| IUPAC名 Pyridinium chlorochromate | |||
| 别名 | PCC | ||
| 识别 | |||
| CAS号 | 26299-14-9 | ||
| ChemSpider | 10608386 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | LEHBURLTIWGHEM-YOEUSAHMAN | ||
| 性质 | |||
| 化学式 | C5H5NHClCrO3 | ||
| 摩尔质量 | 215.56 g·mol⁻¹ | ||
| 外观 | 橙黄色结晶粉末[1] | ||
| 熔点 | 205 °C | ||
| 溶解性(其它溶剂) | 溶于二氯甲烷、 苯、乙醚、 丙酮、乙腈、 四氢呋喃 | ||
| 危险性 | |||
| 警示术语 | R:R49-R8-R43-R50/53 | ||
| 安全术语 | S:S53-S45-S60-S61 | ||
| MSDS | external MSDS sheet | ||
| 主要危害 | 氧化性、有毒、易燃 致癌、刺激性 | ||
| NFPA 704 |
 3
3
| ||
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |||
製備與結構
最初始的製備方法是個偶然的發現,它由吡啶加入冷的三氧化铬浓盐酸溶液制备:[2]
- C5H5N + HCl + CrO3 → [C5H5NH][CrO3Cl]
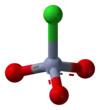
這個化合物由吡啶陽離子([C5H5NH+])和結構為四面體的三氯化鉻陰離子(CrO3Cl-)所組成。實驗可得之相關鹽類,例如:1-丁基吡啶三氧化鉻([C5H5N(C4H9)]+[CrO3Cl]−)。
性质及應用
相關試劑
其他可用於醇氧化反應之更方便且少毒性試劑包含二甲基亞碸為底的氧化反應(如斯文氧化反應、普菲茨納-莫法特氧化反應)和以高價碘為底的氧化反應(如戴斯-馬丁氧化劑)。
参考文献
- Piancatelli, G.; Luzzio, F. A. (2007). "Pyridinium Chlorochromate". e-EROS Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons. doi:10.1002/9780470842898.rp288.pub2.
- Corey, E. J.; Suggs, J. W. (1975). "Pyridinium Chlorochromate. An Efficient Reagent for Oxidation of Primary and Secondary Alcohols to Carbonyl Compounds".Tetrahedron Lett. 16 (31): 2647–2650.doi:10.1016/S0040-4039(00)75204-X.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.