局部麻醉药
局部麻醉药(英語:)是指在意识未消失的状况下使人体某部分失去感觉,以便進行外科手术的药物。普遍应用于口腔科、眼科、婦科和一些外科小手术中,用于暂时解除疼痛。局部麻醉药和全身麻醉药根本区别在于:局部麻醉药与神经膜上的钠离子通道上的某些特定部位结合后,通过钠离子通道的钠离子减少从而改变神经膜电位,导致神经冲动的传导被阻断,最终实现麻醉效果;而全身麻醉剂则是通过影响神经膜的物理性状,比如膜的流体性质、通透性等起到麻醉的作用。
历史
临床最早使用的局部麻醉药是从南美洲古柯树叶中提取的成分。1860年在哥廷根大学的实验室中,德国化学家弗里德里希·维勒的学生Albert Niemann以来自南美洲的古柯叶为原料,提取到一种生物碱晶体,并将其命名为可卡因(cocaine,其中的「coca」来自克丘亚語中的「cuca」),提取的方法記於其博士论文中[1]。「cocaine」一词中的「-caine」之后作为后缀被用于命名人工合成的局部麻醉药。1884年德国眼科医生卡尔·科勒(Karl Koller)的同事弗洛依德發現了可卡因的止痛特性,并告诉了科勒[2][3]。其后科勒发现了可卡因的局部麻醉作用,并首次用于临床[4][5],他将此发现提交到海德堡眼科学会(Heidelberg Ophthalmological Society)。在后来的使用过程中,可卡因的成瘾性和其他一些毒副作用比如致变态反应性、组织刺激性和水溶液不稳定性被先后发现,令它的临床使用受到限制,但对可卡因分子结构的研究和改造使更好的局部麻醉药出现。

通过分析可卡因水解的三种产物:牙子碱(ecgonine)、苯甲酸和甲醇,发现三者都不具有麻醉作用,但用其他羧酸代替苯甲酸与牙子碱成酯之后,麻醉作用降低或完全消失,说明苯甲酸酯的结构是可卡因具局部麻醉作用的主要原因。根据从爪哇古柯树叶分离得到的生物碱托哌可卡因(Tropacocaine)的分子结构进一步证实了苯甲酸酯的局部麻醉作用。后又通过α、β两种优卡因(Eucaine)具有局部麻醉作用推断出莨菪烷的双环结构并非局部麻醉作用所必需的。
1890年德国化学家Eduard Ritsert合成了苯佐卡因并证实它的局部麻醉作用[6],之后又合成出如奥索卡因(Orthocaine)和新奥索仿(New Orthform)这类含有羟基的对氨基苯甲酸酯,它们比苯佐卡因有更强的局部麻醉作用。但是它们的溶解度低,无法配制成水溶液用于注射,若制成盐酸盐则酸性太强,也无法应用。为了克服这个缺点,考虑到可卡因分子中的托哌环有氨基醇结构,氨基醇结构被引入对氨基苯甲酸酯中,1905年德国化学家Alfred Einhorn成功合成了普鲁卡因[7],它的发现使对氨基苯甲酸酯在局部麻醉药中的重要性受到重视,由此发展出一系列的酰胺类、氨基酮类、氨基醚等结构的其他局部麻醉药物。
局部麻醉药的结构类型
局部麻醉药按结构类型可分为对氨基苯甲酸酯类、酰胺类、氨基酮类、氨基醚类、氨基甲酸酯类。
对氨基苯甲酸酯类
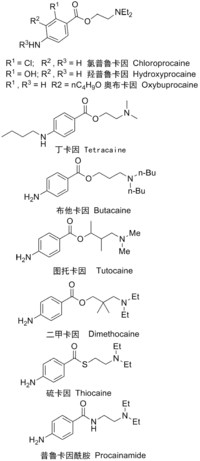
为克服普鲁卡因的麻醉作用不强、不够稳定和易于水解的缺点,一系列取代的对氨基苯甲酸酯化合物被合成出来作为普鲁卡因的代替品。利用在普鲁卡因分子上的苯环邻位引入取代基以增加酯基周围空间位阻减慢水解速率的方法来增強局部麻醉效果[8]。比如氯普鲁卡因(Chloroprocaine)、奥布普鲁卡因(Oxybuprocaine)、羟普鲁卡因(Hydroxyprocaine)和丁卡因(Tetracaine)。改变侧链氨基上的取代基或在侧链上引入支链烃基能够得到比普鲁卡因的局部麻醉效果更强的化合物[8],比如布他卡因(Butacaine)、二甲卡因(也称地美卡因,Dimethocaine)、图托卡因(Tutocaine)。羧酸酯中的氧原子被等电子排体(isostere)S原子置换后得到的硫卡因(Thiocaine),脂溶性增大,局部麻醉效果更强。
酰胺类
酰胺类局部麻醉药的研究是受到在1935年被首次分离得到的具有麻醉作用的天然生物碱Isogramine的启发而开始的[9],由Isogramine结构的确定而导致了酰胺类局麻药利多卡因(Lidocaine)的合成[10][11]。利多卡因可被視為Isogramine的开链类似物或生物电子等排类似物[12],利多卡因的局部麻醉效果比普鲁卡因更强,作用时间延长1倍,穿透性、扩散性更强,无刺激性,主要应用于阻滞麻醉和硬膜外麻醉(epidural anaesthesia),也被用作抗心律失常药。
氨基酮类
以等电子结构-CH2-代替酯基的-O-则为酮类化合物。在氨基酮类中许多化合物都有局部麻醉效果,在临床上有应用价值的如达克罗宁(dyclonine),表面麻醉作用强,显效快。
氨基醚类
用醚键代替局部麻醉药结构中的酯基或酰胺基,有两个化合物奎尼卡因(Quinisocaine)和普莫卡因(Pramocaine)曾被临床使用作为表面麻醉剂。
氨基甲酸酯类
具有氨基甲酸酯结构的药物有地哌冬(Diperodon)和庚卡因(Heptcaine),前者作为表面麻醉剂曾用于临床,后者被发现其表面麻醉作用超过可卡因100倍,也可用于抗心律失常。
局部麻醉药的构效关系
局部麻醉药的化学结构类型较多,有酯、酰胺、酮、醚和氨基甲酸酯等类型,很难用一个通式表示其结构,结构特异性小。根据临床使用的大部分局部麻醉剂的结构可以概括出局部麻醉药的基本骨架,分为三个部分:亲脂部分、中间连接链和亲水部分。
亲脂部分
一般是芳烃和杂环芳烃,但是苯环的作用强,是药物的必需结构。
中间连接部分
这个部分一般是羰基和烷基共同构成的,羰基与局部麻醉药的持续时间和麻醉强度有关。麻醉持续时间的排序为:酮>酰胺>硫代酯>酯,化合物作用时间和稳定性与在体内的水解程度呈反比关系;麻醉强度的排序为:硫代酯>酯>酮>酰胺。
亲水部分
这个部分大部分是叔胺(tertiary amine),可形成易溶于水的盐酸盐。
局部麻醉药的作用机理
神经信号的传递是通过神经细胞膜的微小去极化作用使钠离子通道打开后钠离子瞬间迅速内流来实现的。局部麻醉药物能阻断感觉神经冲动的发生和传导,通过直接与神经细胞膜上的钠离子通道相互作用,使神经纤维的兴奋阈值上升,细胞膜的通透性下降,阻滞动作电位的产生和神经冲动的传递,最终产生局部麻醉的效果。局部麻醉药物具体的作用机理研究尚未有明确的定论,有多种理论被提出,一些研究者提出的理论认为局麻药物分子是与细胞膜上的膜磷脂发生了作用[15][16],另一些则提出药物分子与细胞膜有关的蛋白产生了作用[17][18],还有一些观点认为局麻药物分子是与膜上的特定受体作用[19][20],这些受体影响或控制着某些特定膜蛋白例如(Na+-K+)-ATP酶[21][22]、(Ca2+-Mg2+)-ATP酶[23][24]、腺苷酸环化酶[25][26]和鸟苷酸环化酶[27]、磷脂酶A2[28]和钙调蛋白敏感酶(calmodulin-sensitive enzyme)[29][30]的功能。这些酶能对钾、钙、钠离子在神经细胞膜上的通透性造成影响。
大多数局部麻醉药物都有叔胺结构,叔胺的pKa在7.5至9.0之间,在生理环境的pH值下存在着质子化的阳离子形式[BH+]和其游离态的分子形式[B]之间的动态平衡,两者的比例可由pH=pKa + lg([BH+]/[B])计算得出。1969年,Narahashi等人通过研究改变pH对局麻药物利多卡因的两种衍生物6211(它的pKa=6.3)和6603(pKa=9.8)作用强度的影响结果提出了:药物首先是以游离态分子的形式通过神经细胞膜的,接着以质子化的阳离子形式与钠离子通道内的受体部位结合作用,起到局部麻醉的效果[31],利多卡因90%的局麻效果是由其阳离子贡献的,仅10%归因于其分子形式,且二者的结合位点不同,分子形式的结合位点与苯佐卡因、苯甲醇等电中性局部麻醉药物相同。随后Narahashi通过研究改变pH值对季胺盐阳离子hemicholinium-3和两种利多卡因季胺盐衍生物QX-314(分子英文名称:N-[2,6-dimethylphenyl)-carbamoylmethyl] triethylammonium bromide)和QX-572(分子英文名称:N,N-bis(phenylcarbamoylmethyl)dimethylammonium chloride)麻醉神经效果的影响,进一步确认了局部麻醉药在神经膜内以阳离子的形式与特定受体部位结合阻断动作电位最终起到局部麻醉作用的机理假设[32]。
1977年Hille提出了局部麻醉药的阳离子[BH+]、季铵盐化合物及分子形式[B]作用于钠离子通道单一受体的理论。根据药物分子的大小、pKa和疏水性的差别,药物有多条到达受体结合位点的通路,质子化的局部麻醉药物和阳离子季铵盐化合物仅能在钠离子通道活化时由膜外部的亲水通路进入钠离子通道到达受体位点;而脂溶性的药物分子进入膜内后再以质子化的形式[BH+]进入钠离子通道内,或以分子形式[B]直接经疏水通路与同一受体结合位点结合,产生局部麻醉效果[33][34]。
局部麻醉药物的酯水分配系数对药物在体内的转运和分布有影响。亲水性有利于药物穿透体内的细胞和组织液,迅速转运和分布,而脂溶性有助于通过各种生物膜到达疏水的神经纤维。但是如果脂溶性太大又易穿透血脑屏障會产生不必要的全身麻醉作用。亲脂性和亲水性在药物分子中呈适当比例才有利于局部麻醉效果的产生。
局部麻醉药的应用范围
在临床上,局部麻醉药物可被应用于:
- 表面麻醉(topical anaesthesia)
- 浸润麻醉(infiltration anaesthesia)
- 椎管内麻醉(Spinal anesthesia)
- 丛神经麻醉(Plexus anesthesia)
- 阻滞麻醉(blockanaesthesia)
- 硬脊膜外麻醉(epidural anaesthesia)
- 体腔局部麻醉(Local anesthesia of body cavities),比如胸腔麻醉和关节麻醉
有局部麻醉作用的天然化合物
一些非可卡因结构衍生的、不具有与可卡因类化合物类似结构的天然化合物也具有局部麻醉作用,它们是:
这些天然化合物中,凡是其英文名中有词后缀-toxin的化合物都是有神经毒性的,它们的麻醉机制不同于人工合成的衍生自可卡因的那些局部麻醉药。
参考文献
- Albert Niemann. . Archiv der Pharmazie. 1860, 153 (2): 129–256. doi:10.1002/ardp.18601530202.
- David Galbis-Reig. . International Congress Series. 2002, 1242: 571–575. doi:10.1016/S0531-5131(02)00606-4.
- . [2012-08-03]. (原始内容存档于2012-07-31).
- Wyklicky, H. . Wien. Klin. Wochenschr. (Austria). May 1985, 97 (10): 449–50. ISSN 0043-5325. PMID 3892931.
- Gunther, B. . Revista médica de Chile (Chile). November 1984, 112 (11): 1181–5. ISSN 0034-9887. PMID 6399393.
- Biography of Eduard Ritsert (in German): Deutsche Biographie: Ritsert, Eduard . 页面存档备份,存于
- Ritchie, J. Murdoch; Greene, Nicholas M. (1990). "Local Anesthetics". In Gilman, Alfred Goodman; Rall, Theodore W.; Nies, Alan S. et al.. Goodman and Gilman's The Pharmacological Basis of Therapeutics (8 ed.). New York: Pergamon Press. p. 311. ISBN 0-08-040296-8.
- 郑虎主编,人民卫生出版社,药物化学(第六版),ISBN 9787117090230
- (PDF). [2012-07-31]. (原始内容 (PDF)存档于2014-02-10).
- Nils Löfgren (1948). Studies on local anesthetics: Xylocaine: a new synthetic drug (Inaugural dissertation: Stockholm University). Stockholm, Sweden: Ivar Heggstroms.
- See also:
- William O. Foye, Thomas L. Lemke, Foye's Principles of Medicinal Chemistry (6th edition) p. 463-463 ISBN 0-78-176879-9
- Br. J. Anesth. 1996, 76,300-307
- Mol. Pharmaco. 1998, 54,1,162-169
- Keluskv. E. C.; Smith. I. C. P. Mol. Pharmacol. 1984, 26: 314. 缺少或
|title=为空 (帮助) - Eftink, M. R.; Puri, R. K.; Ghahramani, M. D. . Biochim. Biophys. Acta. 1985, 813 (1): 137–40. PMID 3970914.
- Wefer, M.; Changeux, J. P. Mol. Pharmacol. 1974, 10: 35. 缺少或
|title=为空 (帮助) - Trudell, J. R. Anesthesiology 1977, 46, 5
- Hille, B. In Theories of Anesthesia; General Perturbations Versus Specific Receptors, Progress in Anesthesiology; Fink,B. R., Ed; Raven: New York, 1980; Vol. 2, pp 1-5.
- Postma, S. W.; Catterall, W. A. Mol. Pharmacol. 1984, 25, 219.
- Henn, F. A,; Sperelakia, N. Biochim. Biophys. Acta 1968,163, 415.
- Anderson, N. B. J. Pharmacol. Exp. Ther. 1968, 163, 393.
- Roufogalis, B. D. Biochim. Biophys. Acta 1973, 318, 360.
- Garcia-Marti, E.; Guitierrez-Merino, C. J. Neurochem. 1986, 47, 668.
- Voeikov, V. V.; Lefkowitz, R. J. Biochim. Biophys. Acta 1980, 629, 266.
- Gordon, L. M.; Di ple, I. D.; Sauerheber, R. D.; Esgate, J. A.;Houslay, M. D. J. Supramol. Struct. 1980, 14, 21
- Richelson, E.; Prendergaat, F. G.; Divenets-Romero, S. D. Biochem. Pharmacol. 1978,27, 2039.
- Waite, M.; Sisson, P. Biochemistry 1972, 11, 3098.
- Volpi, M.; Shaàfi, R. I.; Epstein, P. M.; Andrenyak, D. M.; Feinstein, M. B. Proc. Natl. Acad. Sci. U.S.A. 1981, 78,795.
- Tanaka, T.; Hidaka, H. Biochem. Biophys. Res. Commun. 1981,101, 447.
- Narahashi T, Frazier T, Yamada M. . J Pharmacol Exp Ther. 1970, 171 (1): 32–44. PMID 5410936.
- Frazier DT, Narahashi T, Yamada M. . J Pharmacol Exp Ther. 1970, 171 (1): 45–51. PMID 5410937.
- Hille B. . J Gen Physiol. 1977, 69 (4): 475–496. PMID 16078.
- Hille B. . J Gen Physiol. 1977, 69 (4): 497–515. PMID 300786.