方解石
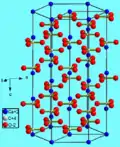
方解石(英語:)是碳酸鈣(化学式:CaCO3)的穩定形態,呈现菱面体或偏三角面体,聚形呈钉头或犬牙状。其中,菱面体有双折射性。
| 方解石 | |
|---|---|
 | |
| 基本資料 | |
| 類別 | 碳酸鹽 |
| 化學式 | 碳酸鈣- CaCO3 |
| 性質 | |
| 分子量 | 100.09 u |
| 顏色 | 無色、白、粉紅、黃、棕色等 |
| 晶体惯态 | 各種型態 |
| 晶系 | 三方或六方晶系 |
| 解理 | {1011}良好解理 |
| 斷口 | 貝殼狀 |
| 韌性/脆性 | 易脆 |
| 摩氏硬度 | 3 |
| 光澤 | 玻璃或珍珠光澤 |
| 條痕 | 白色 |
| 透明性 | 透明至半透明 |
| 比重 | 2.71 |
| 折射率 | nω = 1.640 - 1.660 nε = 1.486 |
| 發光性 | 有螢光性 |
| 溶解度 | 溶於稀鹽酸 |
方解石晶体属三方晶系的碳酸鹽礦物[1],在地球的表面廣泛分佈,石灰岩和大理岩中含有方解石。 在溫泉區中也可以找到方解石,它是溫泉區的礦脈礦物, 在地洞穴中鐘乳石和石筍也可以找到方解石, 方解石還是海洋生物外殼組成的成份,浮游生物,有孔蟲類,紅色海藻的堅硬部份,一些海綿、棘皮動物、苔蘚蟲門,和牡蠣殼的主要成份。霰石加熱到470°C會變成碳酸鈣。
外观
种类
冰洲石

冰洲石是一種無色透明的方解石,因盛产于冰岛而得名,常作为观赏收藏用。非常纯净完全透明的冰洲石晶体具有强烈双折射功能和最大的偏振光功能。将冰洲石放在画有线条的纸上,就能看到线条会变成双重影像。[7]
如果方解石的内部不含杂质或裂痕,不带双晶或歪曲,并且晶体达到一定大小,就可以切割成柱状,用于制作显微镜的棱镜,是无法用人造晶体替代的高级材料。[8]
大理石
大理石(Marble)是经过变质作用的方解石,通常为不透明的块状结晶,可能出现绿、灰、棕与红色,夹杂着石灰石等其他伴生矿物(Accessory minerals)。由于大理石成分较复杂,有时并不被视为方解石的一种,但其大部分的成分仍为方解石。[9]
分布
方解石是分布最广的矿物之一,是组成石灰岩和大理岩的主要成分。在泉水中可沉积出石灰华,在火成岩内亦常为次生矿物,在玄武岩流的杏仁孔穴中,沉积岩之裂缝内常有方解石充填而成细脉,或透过生物学作用,以贝壳或岩礁的方式产出。[10]
用途
方解石在冶金工业上用做熔剂,在建筑工业方面用来生产水泥、石灰。 玻璃生产中加入方解石成份,生成的玻璃会变得半透明,适用于做玻璃灯罩。[11]
方解石还可入药,有清热利湿;通脉解毒等功效,可治疗胸中留热结气,黄疸等。相信矿石疗法认为,方解石有稳定情绪的作用,还有人相信方解石球有聚财的功效[7]。
参考文献
- . 中国科普博览. [2017-07-14].
- 朱倖谊. . 中国轻工业出版社. 2011-01-01. ISBN 7501977275.
- 李时珍.
 本草纲目. 方解石. 1596.
本草纲目. 方解石. 1596. - 潘國樑. . 台灣五南圖書出版股份有限公司. 2013-10-23: 42. ISBN 9571173711.
- Wolfgang F. Tegethoff, [方解石 在 Google Books 的內容。 Calciumcarbonat Von der Kreidezeit ins 21. Jahrhundert], Springer-Verlag. 2013: pp. 10, ISBN 978-3-0348-8259-0 (德文)
- . mindat.org and the Hudson Institute of Mineralogy. [2017-07-14].
- 陸啟萍; 杜雨潔. . 台灣書泉出版社. 2015-02-02: 202. ISBN 9861216480.
- 刘显凡; 孙传敏. 第二版. 北京: 地质出版社. 2013: 214–215.
- 朱倖誼. . 積木文化. 2013-03-13: 210. ISBN 9865865041.
- . Volcano Research Lab. [2017-07-14].
- . 中国粉体技术网. [2017-07-14]. (原始内容存档于2017-06-12).
外部链接
- (英文)Webmineral:Calcite Mineral Data