硫化锂
| 硫化锂 | |
|---|---|
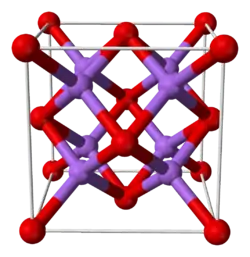 | |
| IUPAC名 Lithium hydrosulfide | |
| 识别 | |
| CAS号 | 12136-58-2 |
| PubChem | 10290727 |
| ChemSpider | 8466196 |
| SMILES |
|
| InChI |
|
| EINECS | 235-228-1 |
| RTECS | OJ6439500 |
| 性质 | |
| 化学式 | Li2S |
| 摩尔质量 | 45.95 g·mol⁻¹ |
| 外观 | 白色固體 |
| 密度 | 1.66 g/cm3 |
| 熔点 | 938 °C (1211 K) |
| 沸点 | 1372 °C (1645 K) |
| 结构 | |
| 晶体结构 | 反萤石型 (立方),cF12 |
| 空间群 | Fm3m, No. 225 |
| 配位几何 | 四面体 (Li+);八面体 (S2–) |
| 热力学 | |
| ΔfHm |
-9.401 kJ/g |
| 危险性 | |
欧盟危险性符号 腐蚀性 C 腐蚀性 C | |
| MSDS | 英文 · 中文 |
| 欧盟编号 | 未列出 |
| NFPA 704 |
 1
3
1
|
| 相关物质 | |
| 其他阴离子 | 氧化鋰、硒化鋰、硒化锂、碲化锂、釙化锂 |
| 其他阳离子 | 硫化鈉 硫化鉀 硫化銣 硫化銫 硫化鈁 |
| 相关化学品 | 氫化鋰 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
性质
白色至黄色晶体。在空气中吸收水分并水解,放出硫化氢气体。易溶于水,能溶于乙醇。具反萤石型结构。可被酸分解放出硫化氢;可与硝酸剧烈反应,但氢溴酸与氢碘酸只有在加热的情况下才能将其分解。与浓硫酸反应很缓慢,但同稀硫酸剧烈反应。300°C时,被氧气氧化,生成硫酸锂但不生成二氧化硫。
制备
硫化锂可通过多种方法制取。过去曾用锂与硫单质共同加热进行反应,以及在加热条件下用碳或氢气还原硫酸锂的方法来制取硫化锂。后来发现锂与硫在液氨中作用,或乙氧基锂分解硫氢化锂的乙醇加合物都可以制得硫化锂。此后有人用戊氧基锂与硫化氢反应先制得硫氢化锂,再使硫氢化锂在真空加热分解来制备硫化锂。
用途
为可充电锂离子电池中的潜在电解质材料。
参考资料
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
