碘化镁
碘化镁是一种无机化合物,理论上化学式为MgI2。由于通常含有结晶水,它的化学组成可以表示为MgI2(H2O)x。这些盐是典型的离子化合物,易溶于水。碘化镁的商业用途较少,但它可用作有机合成的试剂。
| 碘化镁 | |||
|---|---|---|---|
| |||
| |||
| IUPAC名 Magnesium iodide | |||
| 识别 | |||
| CAS号 | 10377-58-9 (无水) 75535-11-4(六水合物) 7790-31-0(八水合物) | ||
| PubChem | 66322 | ||
| ChemSpider | 59700 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | BLQJIBCZHWBKSL-NUQVWONBAV | ||
| 性质 | |||
| 化学式 | MgI2(无水) MgI2·6H2O(六水合物) MgI2·8H2O(八水合物)[1] | ||
| 摩尔质量 | 278.1139 g/mol(无水) 386.2005 g/mol(六水合物) 422.236 g/mol(八水合物) g·mol⁻¹ | ||
| 外观 | 白色晶状固体 | ||
| 氣味 | 无味 | ||
| 密度 | 4.43 g/cm³(无水) 2.353 g/cm(六水合物) 2.098 g/cm³(八水合物) | ||
| 熔点 | 637 °C(无水,分解) 41 °C (八水合物,分解) | ||
| 溶解性(水) | 54.7 g/100 cm³(无水, 0 °C) 148 g/100 cm³(无水, 18 °C)[2] 81 g/100 cm³(八水合物, 20 °C) | ||
| 溶解性 | 溶于乙醚、乙醇和液氨 | ||
| 结构 | |||
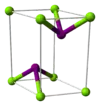
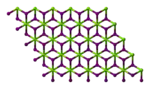
| 晶体结构 | 六方晶系(无水) 单斜晶系(六水合物) 正交晶系(八水合物) | ||
| 危险性 | |||
| 警示术语 | R:R36 R38 R42 R43 R61 | ||
| 安全术语 | S:S22 S36/37/39 S45 S53[3] | ||
| NFPA 704 |
 1
3
1
| ||
| 相关物质 | |||
| 其他阴离子 | 氟化镁 溴化镁 氯化镁 | ||
| 其他阳离子 | 碘化铍 碘化钙 碘化锶 碘化钡 | ||
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |||
反应
碘化镁可以由氧化镁、氢氧化镁或碳酸镁与氢碘酸反应制得[4]:
碘化镁在氢气气氛中即使加强热也是稳定的,但在空气中常温下就会分解,并因为产生了碘单质而变成棕色。在空气中加热时,它完全分解成氧化镁[5]。
此外还可以将碘的粉末与镁粉混合来制备碘化镁。如果想获得无水碘化镁,此反应需要在严格无水的环境中进行,例如可以使用无水乙醚作为溶剂。也可以将MgI2·8H2O先后在干燥的碘化氢和氮气气流中加热脱水来制备无水碘化镁[6]。
应用
在Baylis-Hillman反应中使用碘化镁可以获得含有Z型的乙烯基的化合物[7]。
参考资料
- Perry, Dale L.; Phillips, Sidney L., , CRC Press: 240, 1995 [2007-12-09], ISBN 0849386713
- Magnesium Iodide MSDS at AlfaAesar
- Safety (MSDS) data for magnesium iodide
- Patnaik, Pradyot, , McGraw-Hill Professional: 527–528, 2003 [2007-12-09], ISBN 0070494398
- Wilsmore, N. T. M. . James Hector (编). . Sydney: The Association: 116. 1891 [2007-12-09]. (原始内容存档于2012-11-13).
- 张青莲. . 北京: 科学出版社. 1983: P164–165.
- Tietze, Lutz-Friedjan; Brasche, Gordon; Gericke, Kersten, , Wiley-VCH: 59, 2006 [2007-12-09], ISBN 3527290605
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.