过氧化钠
| 过氧化钠 | |
|---|---|
 | |
 | |
 | |
| 英文名 | |
| 别名 | 二氧化二钠 |
| 识别 | |
| CAS号 | 1313-60-6 |
| PubChem | 14803 |
| ChemSpider | 14119 |
| SMILES |
|
| UN编号 | 1504 |
| EINECS | 215-209-4 |
| RTECS | WD3450000 |
| 性质 | |
| 化学式 | Na2O2 |
| 摩尔质量 | 78 g·mol⁻¹ |
| 外观 | 白色至黄色粉末 |
| 密度 | 2.8 g/cm3 |
| 熔点 | 675 °C |
| 溶解性(水) | 反应 |
| 结构 | |
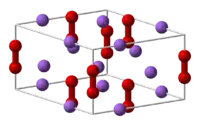
| 晶体结构 | 六方[1] |
| 危险性 | |
| 警示术语 | R:R7-R14-R26/27/28-R29-R41 |
| 安全术语 | S:S7/8-S37/39 |
| MSDS | 英文MSDS |
| 主要危害 | 强氧化性、与水反应 |
| NFPA 704 |
 0
3
1
|
| 相关物质 | |
| 其他阳离子 | 过氧化氢、过氧化锂 过氧化钙 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
物理性质
在常温下,纯品过氧化钠为白色,但一般见到的过氧化钠呈淡黄色(混有 超氧化钠 的缘故),密度为2.805g/cm3,熔点为460摄氏度。加热时,过氧化钠的颜色会变黄。过氧化钠易变质,应密封保存。过氧化钠对人有强烈的腐蚀性,与易燃物接触易引起火灾,在高温下甚至会发生爆炸。过氧化钠着火不能用水扑灭,必须用沙土或盐盖灭。
制取
过氧化钠主要靠钠的燃烧来制取(得到的产物一般含有约10%的超氧化钠),工业上将钠装入铝盘,通入干燥且不含二氧化碳的空气,先保持180~200摄氏度,使钠氧化成氧化钠(Na2O),再增加通入气体量,同时升温至300~400摄氏度,即可得到纯净的过氧化钠。
其化学反应方程式为:
过氧化钠也可以通过过氧化氢与氢氧化钠的反应制取,化学方程式为:
化学性质
过氧化钠是离子化合物,其中氧元素显-1价,钠元素显+1价,其水合物有Na2O2‧2H2O和Na2O2‧8H2O两种。
过氧化钠是强氧化剂,可以与多种金属单质以及非金属化合物发生反应。
这是一个放热反应,又由于生成物中含有氧气,因此极易引起可燃物的燃烧和爆炸。
过氧化钠与稀硫酸反应,生成硫酸钠(Na2SO4)、水和氧气:
可以把过氧化钠溶解在低温的硫酸中,然后减压蒸馏即可得到过氧化氢(H2O2):
类似的还有与盐酸的反应:
在碱性环境中,过氧化钠可以把化合物中+3价的砷(As)氧化成+5价,把+3价的铬(Cr)氧化成+6价。利用这个反应可以将某些岩石矿物中的+3价铬除去,方法为:在600~700摄氏度的高温下用过氧化钠将铁矿中的3价铬氧化成Na2CrO4,而Na2CrO4可以用水溶掉:
另外,过氧化钠可以将铁单质氧化成含FeO42−的铁酸盐,还可以在一般条件下将有机物氧化成乙醇和碳酸盐,也可以与硫化物和氯化物发生剧烈反应。
过氧化钠的热稳定性好,可加热到熔融状态而不分解。
用途
由于过氧化钠具有强氧化性,因此可以用来漂白织物、麦杆、羽毛等,也可用做除臭剂或消毒剂。在分析化学上用于处理矿样。由于它和二氧化碳反应放出氧气,因此可以用来在潜水艇等缺少氧气的环境中提供供人呼吸的氧气。
參考文獻
- Tallman, R. L.; Margrave, J. L.; Bailey, S. W. J. Am. Chem. Soc. 1957, 79, 2979-80.