过氧化氢
过氧化氢,分子式H2O2,是除水外的另一种氢的氧化物。粘性比水稍微高,化学性质不稳定,一般以30%或60%的水溶液形式存放,其水溶液俗称双氧水。过氧化氢有很强的氧化性,且具弱酸性。
| 过氧化氢 | |||
|---|---|---|---|
 | |||
| |||
| IUPAC名 hydrogen peroxide 过氧化氢 | |||
| 别名 | 双氧水 二氧烷 (dioxidane) 氧烷基 (oxidanyl) 过羟酸 (perhydroxic acid) 0-羟醇 (0-hydroxyol) | ||
| 识别 | |||
| CAS号 | 7722-84-1 | ||
| PubChem | 784 | ||
| SMILES |
| ||
| RTECS | MX0900000 | ||
| 性质 | |||
| 化学式 | H2O2 | ||
| 摩尔质量 | 34.0147 g·mol⁻¹ | ||
| 外观 | 淡蓝色液体 溶液无色 | ||
| 密度 | 1.463 g/cm3 (液) | ||
| 熔点 | −0.43 °C(31.23 °F;272.72 K) | ||
| 沸点 | 150.2 °C(302.4 °F;423.3 K) | ||
| 溶解性(水) | 混溶 | ||
| pKa | 11.65 | ||
| 黏度 | 1.245P,當室溫為20 °C(68 °F;293 K) | ||
| 偶极矩 | 2.26D | ||
| 危险性 | |||
| 警示术语 | R:R5-R8-R20-R22-R35 | ||
| 安全术语 | S:S1/2-S17-S26-S28-S36-S37-S39-S45 | ||
| MSDS | 30%过氧化氢—MSDS 60%过氧化氢—MSDS | ||
| 主要危害 | 氧化性、腐蚀性 | ||
| NFPA 704 |
 0
3
2
OX
| ||
| 闪点 | 不可燃 | ||
| 致死量或浓度: | |||
LD50(中位剂量) |
1518 mg/kg | ||
| 相关物质 | |||
| 相关化学品 | 水、臭氧、肼 硫氧化氫、二硫化氫、多硫化氢 | ||
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |||
性质
纯过氧化氢是淡蓝色的粘稠液体,熔点−0.43 °C(31.23 °F),沸点150.2 °C(302.4 °F)。凝固点时固体密度为1.71g/cm3,密度随温度升高而减小。它的缔合程度比H2O大,所以它的介電係數和沸点比水高。纯过氧化氢比较稳定,若加热到153 °C(307 °F)便猛烈的分解为水和氧气。
过氧化氢可与水以任意比例互溶,因其可以发生微弱电离,所以溶液呈弱酸性。
- H2O2 ↔ H+ + HO2- Ka1=2.4×10-12
- HO2- ↔ H+ + O22- Ka2≈10-25
过氧化氢与过量氢氧化钠反应的产物是Na2O2和H2O。而与氢氧化钡反应时产物为过氧化钡。
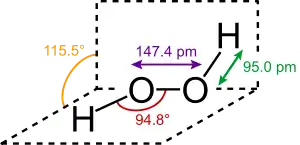
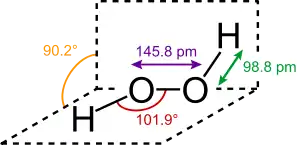
过氧化氢分子为椅型结构,上图为气态时的结构,下图为固态晶体时的结构:
制备
1950年代以前采用电解法制备过氧化氢——电解硫酸氢盐溶液(如硫酸氢铵、硫酸氢钾)得到过二硫酸盐[1],再加入硫酸[2]得到过氧化氢。
1953年,杜邦公司采用蒽醌法制备,以烷基蒽醌如2-乙基蒽醌为媒介物,循环氧化还原製得。现在世界各国基本上都是用这一技术。
反应
| 氧化剂 | 氧化电位 V |
|---|---|
| 氟气 | 3.0 |
| 羟基自由基 | 2.8 |
| 臭氧 | 2.1 |
| 过氧化氢 | 1.8 |
| 高锰酸钾 | 1.7 |
| 二氧化氯 | 1.5 |
| 氯气 | 1.4 |
过氧化氢是非常强的氧化剂,它和其他氧化剂的标准电极电势值列在右面,值越高代表氧化性越强:
分解反应
该反应在热力学上自发进行:ΔHo为−98.2 kJ·mol−1,ΔGo为−119.2 kJ·mol−1,ΔS为70.5 J·mol−1·K−1。重金属离子Fe2+、Mn2+、Cu2+等对过氧化氢的分解有催化作用。它们在酸性溶液中的电势介于过氧化氢的电势(0.694~1.76V)之间。例如Fe3+,认为过氧化氢把Fe3+还原为Fe2+,而本身被氧化成氧气,产生的Fe2+又被过氧化氢氧化为Fe3+,过氧化氢被还原成水。过氧化氢在酸性和中性介质中较稳定,在碱性介质中易分解。用波长为320~380nm的光照射会使过氧化氢分解速度加快,故过氧化氢应盛于棕色瓶中并放在阴凉处。在处理无水或浓缩过氧化氢时,必须在无尘、无金属杂质等条件下进行,以防止发生爆炸。H2O2与Fe2+的混合溶液称为芬顿试剂(Fenton)。某些离子如Fe2+、Ti3+催化下,过氧化氢分解反应会生成自由基中间体HO·(羟基自由基)和HOO·。一般使用的双氧水中都会含有一定量的稳定剂,以减少过氧化氢的分解。常用的稳定剂包括:锡酸钠、焦磷酸钠、8-羟基喹啉和有机亚磷酸酯。[5]
氧化还原反应
过氧化氢可在水溶液中氧化或还原很多无机离子。用作还原剂时产物为氧气;用作氧化剂时产物为水,其优点是氧化性强,还原产物为水,不引入杂质且不污染环境,因此过氧化氢是一种用途十分广泛的氧化剂。例如酸性溶液中,过氧化氢可将Fe2+氧化为Fe3+:
与过氧化氢作用,亚硫酸根(SO2−
3)可被氧化为硫酸根(SO2−
4),高锰酸钾在酸性溶液中会被还原为Mn2+。由于标准电极电势的缘故,反应在不同pH环境下进行的方向可能不同,如碱性溶液中,过氧化氢会将Mn2+氧化为MnIV,以MnO2形式生成。
过氧化氢还原次氯酸钠的反应可用于在实验室中制备氧气:
有机化学中,过氧化氢常用作氧化剂,可将硫醚氧化为亚砜。甲基苯基硫醚与其反应时,会被氧化为甲基苯基亚砜,以甲醇作溶剂或三氯化钛催化,产率为99%:
生成过氧化物
过氧化氢与很多无机或有机化合物反应时,过氧链保留并转移到另一分子上,生成新的过氧化物:
- 过氧化氢在低温下与铬酸或重铬酸盐酸性溶液反应时,会生成不稳定的蓝色过氧化铬CrO(O2)2,可用乙醚或戊醇萃取。这个反应可以用来检验过氧化氢和铬酸根或重铬酸根。而在水溶液中过氧化铬会与过氧化氢进一步反应,蓝色迅速消失,得到氧气和铬离子。
- 4H2O2 + Cr2O72- + 2H+ → 2CrO5 + 5H2O
- 7H2O2 + 2CrO5 + 6H+ → 7O2↑ + 2Cr3+ + 10H2O
应用
一般低濃度(如3%)的過氧化氫,主要用於殺菌及外用的醫療用途,例如作為傷口消毒。檢驗血液的最佳比率:6%的雙氧水加上0.005%的亞甲藍。由於過氧化氫較易化解,以界面活化劑等混合過氧化氫(稱為加速過氧化氫Accelerated Hydrogen Peroxide,簡稱AHP)﹐除加強殺菌消毒的效果,也可用作兼具殺菌效能的清潔劑。
至於較高濃度者(大於10%),則用於紡織品、皮革、紙張、木材製造工業,作為漂白及去味劑。過氧化氫也是染髮劑的成份之一,还用作合成有机原料(邻苯二酚)的材料,医药、金属表面处理剂,聚合引发剂等。还可用作火箭推进剂。
很多颜料、涂料中含有铅白。使用铅白的油画、壁画等艺术品长时间暴露在空气中,与硫化氢作用生成硫化铅而变暗发黑,用过氧化氢涂刷后,会生成白色的硫酸铅从而使其复原。
- PbS + 4H2O2 → PbSO4 + 4H2O
历史事件
参见
参考文献
- 电解:KHSO4 → K2S2O8+ H2↑
- K2S2O8 + H2SO4 = K2SO4 + H2S2O8使过二硫酸水解,水解过程分为两步:H2S2O8 + H2O = H2SO5 + H2SO4; H2SO5 + H2O = H2SO4 + H2O2
- Perry, Samuel C.; Pangotra, Dhananjai; Vieira, Luciana; Csepei, Lénárd-István; Sieber, Volker; Wang, Ling; Ponce de León, Carlos; Walsh, Frank C. . Nature Reviews Chemistry. 2019-07, 3 (7): 442–458 [2019-12-18]. ISSN 2397-3358. doi:10.1038/s41570-019-0110-6. (原始内容存档于2020-06-13) (英语).
- Gyenge, E.L.; Oloman, C.W. . Journal of Applied Electrochemistry. 2003-08-01, 33 (8): 655–663. ISSN 1572-8838. doi:10.1023/A:1025082709953 (英语).
- . www.h2o2.com. [2021-01-07].