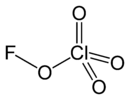
高氯酸氟
高氯酸氟是很少见的含有氯、氧元素的氟化合物,分子式为FOClO3或FClO4。它是极不稳定容易爆炸的气体,[2]具有刺激性气味。[3]
| 高氯酸氟 | |||
|---|---|---|---|
| |||
| 别名 | Fluorine perchlorate | ||
| 识别 | |||
| CAS号 | 10049-03-3 | ||
| ChemSpider | 10326178 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | DRFVFUCINMEBEQ-UHFFFAOYAO | ||
| 性质 | |||
| 化学式 | FClO 4 | ||
| 熔点 | -167.3 °C | ||
| 沸点 | -16 °C | ||
| 热力学 | |||
| ΔfHm |
9 kcal/mol[1] | ||
| 危险性 | |||
| 主要危害 | 易爆气体 | ||
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |||
安全
FClO4能发生许多危险且不可预知的反应, 是一种共价高氯酸盐(氯的氧化态为+7),并有一个十分敏感的O-F单键。少量的还原剂例如有机物就能使其爆炸。这些反应可以产生卤氧化物、卤素互化物以及其他有害物质。
性质
高氯酸氟具有强氧化性,例如与碘离子反应:
- FOClO3 + 2I- → ClO4- + F- + I2
高氯酸氟也能与全氟代烯烃发生加成反应(需在-45℃进行):
- CF2=CF2 + FOClO3 → CF3CF2OClO3[5]
对于不对称烯烃,产物是混合物(因为O-F键的极性很小),主要是不符合马氏规则的,过去称为“亲电氟化”,即其中氟原子显微弱的正电性,现在认为可能是因为这是一个自由基加成反应。[6]
参考资料
- Breazeale, J. D.; MacLaren, R. O.. Thermochemistry of oxygen-fluorine bonding, United Technology Center, Sunnyvale, CA, 1963. Accession Number: AD0402889. Retrieved online from on 2009-05-21.
- Pradyot Patnaik. A comprehensive guide to the hazardous properties of chemical substances, 3rd ed., Wiley-Interscience, 2007. ISBN 0471714585
- Robert Alan Lewis. Lewis' dictionary of toxicology, CRC Press, 1998, p. 508. ISBN 1566702232
- Rohrback, Gilson H.; Cady, George H. . Journal of the American Chemical Society (American Chemical Society (ACS)). 1947, 69 (3): 677–678. ISSN 0002-7863. doi:10.1021/ja01195a063.
- Greenwood, N. N.; Earnshaw, A. 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- Schack, Carl J.; Christe, Karl O. . Inorganic Chemistry. 1979, 18 (9): 2619. doi:10.1021/ic50199a056.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.