高氯酸镁
反应过程需不断搅拌,分多次缓慢加入氧化镁粉末,缓慢滴加高氯酸溶液,溶液呈弱酸性后停止滴加。然后用冷却热饱和溶液的方法结晶,液体表面刚出现结晶薄膜时停止加热,然后过滤可得六水合高氯酸镁,再真空加热制得无水高氯酸镁。
| 高氯酸镁 | |
|---|---|
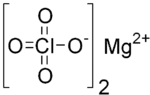 | |
 | |
| 识别 | |
| CAS号 | 10034-81-8 |
| PubChem | 24840 |
| ChemSpider | 23223 |
| SMILES |
|
| InChI |
|
| InChIKey | MPCRDALPQLDDFX-NUQVWONBAH |
| RTECS | SC8925000 |
| 性质 | |
| 化学式 | Mg(ClO4)2 |
| 摩尔质量 | 223.206 g·mol⁻¹ |
| 外观 | 易潮解的白色粉末 |
| 密度 | 2.21 g/cm3 |
| 熔点 | 251 °C |
| 沸点 | 分解 |
| 溶解性(水) | 99.3 g/100 mL |
| 溶解性(乙醇) | 24 g/100 mL |
| 危险性 | |
| 警示术语 | R:R8, R36, R37, R38 |
| 安全术语 | S:S17, S26, S27, S36, S37, S39 |
| MSDS | External MSDS |
| 欧盟编号 | 未提及 |
| NFPA 704 |
 0
1
0
OX
|
| 相关物质 | |
| 其他阳离子 | 高氯酸钙 高氯酸钡 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
高氯酸镁是一种强氧化剂,化学式为Mg(ClO4)2。它可以由氧化镁溶于30%高氯酸制得:
- MgO + 2HClO4 → Mg(ClO4)2 + H2O
或者使饱和高氯酸钠溶液与氯化镁发生复分解反应,过滤除去氯化钠,再用上述方法结晶:
- MgCl2 + 2NaClO4 → Mg(ClO4)2 + 2NaCl
高氯酸镁加热到250 °C即分解并放出氧气,与还原剂、有机化合物、易燃物混合易爆炸。[1]它的标准摩尔生成焓为-568.90 kJ mol-1。[2]
无水高氯酸镁是白色多孔的物质。它的溶解热相当高,因此高氯酸镁在溶液中反应时需用大量水稀释。它是实验室常用的干燥剂,被用于干燥气体样品,它的吸水效率(指足量干燥剂与水蒸气完全反应后气体中的水蒸气浓度)仅次于五氧化二磷,比浓硫酸、氢氧化钾、无水氯化钙等干燥剂高得多。它吸水量也很大,最多可达自身质量的60%。
高氯酸镁遇到水蒸气即结合成六水合高氯酸镁:
- Mg(ClO4)2 + 6H2O → Mg(ClO4)2·6H2O
[3][4]无水高氯酸镁能吸收甲醇、乙醇、丙酮、吡啶、乙腈氨和硝基甲烷的蒸汽,可用來分析有機化合物的成分(會吸收水分),但用它乾燥有機物蒸汽曾發生爆炸,因此必须谨慎使用。科学家也建议不再使用它,因为高氯酸盐对人体有害,[5]吸过水的高氯酸镁在250 °C时真空加热,失去6分子结晶水,又得到无水高氯酸镁。
参考资料
- CRC Handbook of Physics and Chemistry(Version 2010)
- Lange's Handbook of Chemistry (16th Edition)
- H. H. Willard, G. F. Smith. . Journal of the American Chemical Society. 1922, 44 (10): 2255–2259. doi:10.1021/ja01431a022.
- L. Wu, H. He. . The Chemical Educator. 1994, 41 (5): 633–637. doi:10.1016/0039-9140(94)80041-3.
- W. L. F. Armarego and C. Chai. . Oxford: Butterworth-Heinemann. 2003. ISBN 0750675713.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
