乙烷
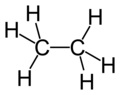
乙烷是化学式为C2H6的烷烃。乙烷中的所有分子由共价键结合,通常在分子的书写中为了表现两个C(碳原子)之间只有一个化学键,写作CH3-CH3。它是由两个碳原子组成的烷烃中唯一的脂肪烃。
| 未解決的化學問題:乙烷中键旋转障碍的本质原因究竟是空间位阻还是超共轭效应? |
| 乙烷 | |||
|---|---|---|---|
| |||
 | |||
| IUPAC名 Ethane | |||
| 识别 | |||
| CAS号 | 74-84-0 | ||
| PubChem | 6324 | ||
| ChemSpider | 6084 | ||
| SMILES |
| ||
| Beilstein | 1730716 | ||
| Gmelin | 212 | ||
| UN编号 | 1035 | ||
| EINECS | 200-814-8 | ||
| ChEBI | 42266 | ||
| RTECS | KH3800000 | ||
| MeSH | Ethane | ||
| 性质 | |||
| 化学式 | C2H6 | ||
| 摩尔质量 | 30.07 g·mol⁻¹ | ||
| 外观 | 无色气体 | ||
| 密度 | 1.212 kg/m³ (气) | ||
| 熔点 | -182.76 °C (90.34 K) | ||
| 沸点 | -88.6 °C (184.5 K) | ||
| 溶解性(水) | 5.68×10-3 g/100 ml | ||
| pKa | 50 | ||
| 危险性 | |||
欧盟危险性符号 极易燃 F+ 极易燃 F+ | |||
| 警示术语 | R:R12 | ||
| 安全术语 | S:S2-S9-S16-S33 | ||
| NFPA 704 |
 4
1
0
| ||
| 闪点 | -135 °C | ||
| 相关物质 | |||
| 相关烷烃 | 甲烷、丙烷 | ||
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |||
在标准状况下乙烷为可燃气体,无色无味,在一定的浓度下如遇火可产生爆炸。
历史
1834年迈克尔·法拉第首次使用电解乙酸钾的方法制造了乙烷。他错误地以为这个反应的产物是甲烷,因此没有继续研究。在1847年和1849年间阿道夫·威廉·赫尔曼·科尔贝和爱德华·弗兰克兰在维护有机化学理论的过程中通过使用金属钾还原丙腈和碘乙烷以及通过电解乙酸盐的方法制造了乙烷。但是他们错误地以为这些反应的产物是甲基自由基,而不是甲基的二聚体乙烷。1864年卡尔·肖莱马校正了这个错误,他证明所有这些反应的产物都是乙烷。
化学性质
乙烷的化学性质主要包括自由基反应,它能够和卤素,尤其是氯和溴发生自由基卤化反应。这个反应主要是通过乙基自由基的链增长导致的:
- C2H5· + Cl2 → C2H5Cl + Cl·
- Cl· + C2H6 → C2H5· + HCl
由于卤化乙烷还可以继续发生自由基卤化,因此这个过程可以产生许多卤化产物的混合物。在化学工业里因此使用更加有选择性的反应来获得特别的二碳卤化物。
燃烧
乙烷完全燃烧的话每摩尔释放1561千焦或者每克施放51.9千焦热量,其燃烧产物是二氧化碳和水:
- 2 C2H6 + 7 O2 → 4 CO2 + 6 H2O + 3120 kJ/mol
乙烷的燃烧实际上是一系列复杂的游离基反应。对乙烷燃烧的化学动力学计算机模拟包括上百单个反应。其中一系列重要的单个反应是乙基和氧的结合和此后的分裂,导致过氧化物,再导致烷氧基和羟基。
- C2H5· + O2 → C2H5OO·
- C2H5OO· + HR → C2H5OOH + ·R
- C2H5OOH → C2H5O· + ·OH
乙烷不完全燃烧的主要产品是单碳化合物如一氧化碳和甲醛。乙烷的碳碳键断开产生这些产品的主要途径是乙基分裂为甲基和甲醛,这些产品然后继续氧化:
- C2H5O· → CH3· + CH2O
不完全燃烧还会产生少量乙醛、甲烷、甲醇和乙醇。在高温下,尤其在摄氏600至900度之间乙烯是一个重要产物。这个反应如下:
- C2H5· + O2 → C2H4 + ·OOH
在使用蒸汽裂解由乙烷生产乙烯的过程中有类似的反应。
生产
乙烷是继甲烷后天然气中最主要的组成部分。不同矿井的乙烷含量从1%至6%体积比不等。1960年代前乙烷和其它大分子一般不被从甲烷中分离出来,而是直接和甲烷一起当作燃料使用。今天乙烷是石化工业的重要原料之一,在设备完备的矿区它们被分离出来。炼油的时候产生的气态碳氢化合物中也包含乙烷。
把乙烷从甲烷中分离出来最有效的方法是使用低温液化。这里有不同的手段。目前最有效的方式是使用涡轮膨胀,使用这种方法可以提取天然气中含有的90%以上的乙烷。在这个过程中冷却的气体通过一个涡轮膨胀,由此降温到攝氏-100度。在这个温度下气态的甲烷可以从液态的乙烷和其它更重的碳氢化合物中蒸馏出来。继续蒸馏可以把乙烷和丙烷以及更重的碳氢化合物分离开来。
使用
在化学工业里乙烷主要用来通过蒸汽裂解生产乙烯。与蒸汽混合被加到摄氏900度或以上的高温时重的碳氢化合物裂解成轻的碳氢化合物,烷烃成为烯烃。相对于其它比较重的原材料而言乙烷在蒸汽裂解过程中相当大的部分成为乙烯,而比它重的化合物则会产生许多混合物,其中包括许多重的烯烃如丙烯、丁二烯以及芳香烃,降低乙烯的成分。
在实验室里也有把乙烷作为其它化学产品的原材料的研究。长时期氯化乙烷的氧化似乎比乙烯氯化用来生产氯乙烯更经济。许多这个反应的过程被报专利。但是由于这个反应的选择性差而且反应条件腐蚀性高因此至今为止没有经济使用。只有英力士在德国威廉港有一个每年一千吨的实验工厂。
沙特阿拉伯基础工业宣称将在延布建造一座每年三万吨的使用氧化乙烷生产乙酸的工厂。这个工厂使用这个过程的经济性主要是依靠使用附近的沙特阿拉伯油田的乙烷达到的,与世界其它地区使用的甲醇碳化它可能无法竞争。
乙烷可以在冷冻设施中作为致冷剂使用。在科学研究中液态的乙烷在电子显微技术中被用来使得含水量高的样本透明化。薄的水层在快速沉浸到设施-150度或更低的液乙烷中时迅速冻结,不会形成晶体。这样的迅速冻结不会像冰结晶时那样会破坏液态水中软物质的结构。
健康和安全
在室温下乙烷是一种可燃气体。假如乙烷中参杂了3%至12.5%体积的空气的话它会发生爆炸。
把乙烷当作致冷剂存放的时候还要注意其它事项。直接与液乙烷接触会导致冻伤。液乙烷蒸发的气体在达到室温前比空气重,因此会聚集在低处,假如他们遇到火的话会点燃并且传播回到它们蒸发出去的液体。
装乙烷的容器在刚刚倒空后还可能缺氧会导致窒息,除此之外乙烷目前没有已知的毒性或者其它紧急威胁。至今为止没有乙烷致癌的迹象。
地球大气和外星

在地球大气层中乙烷是一种痕量气体,目前在海平面其浓度约为五亿分之一,在工业革命前它的浓度可能还要低得多,因为今天大气中的大多数乙烷可能是由于未被燃烧的化石燃料释放出来的。虽然乙烷是一种温室气体它比甲烷要少得多,其温室效应也要低。在氣體巨星和土星的卫星土卫六的大气中也发现有少量乙烷。
大气中的自然乙烷是由太阳光化学反应从甲烷导致的:波长约为160纳米的紫外线可以把甲烷分子分解为甲基和氢原子。两个甲基组合为乙烷:
- CH4 → CH3· + ·H
- CH3· + ·CH3 → C2H6
有推测认为这样在土卫六的大气里形成的乙烷可能会下雨返回到卫星的表面并逐渐聚集成碳氢化合物组成的湖或者海洋覆盖在卫星的表面。红外线望远镜的观察对这个推测提出强烈的怀疑。2005年在土卫六上着陆的惠更斯号探测器没有观测到任何表面液体,但是它的照片上一些地形好像是干燥的河床。2007年12月卡西尼号探测器在土卫六的南极发现了一个被命名为安大略湖的湖,这个名字是因为它的面积类似地球上的安大略湖(约两万平方公里)。2008年7月的红外线望远镜观测提供了强烈线索说明安大略湖含有液态的乙烷[1]。
1996年在百武二號彗星中发现乙烷,此后在其它一些彗星中也发现了乙烷。在这些太阳系远处的天体中发现乙烷可能表明在形成太阳和行星的星云里就已经有乙烷了。