大蒜素
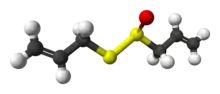
大蒜素(Allicin)是从石蒜科[1]蔥亞科葱属植物大蒜(Allium Sativum)的鳞茎(大蒜头)中提取的一种有机硫化合物,也存在于洋葱和其他葱科植物中。[2] 学名「二烯丙基硫代亚磺酸酯」(CH2=CH-CH2-S(=O)-S-CH2-CH=CH2)[3][2][4][5],(R-S(=O)-S-R)一族。
| 大蒜素 | |
|---|---|
 | |
 | |
| IUPAC名 2-propene-1-sulfinothioic acid S-2-propenyl ester | |
| 英文名 | |
| 别名 | 蒜辣素;蒜素;大蒜辣素;二烯丙基二硫-氧[S]化合物;大蒜新素 |
| 识别 | |
| CAS号 | 539-86-6 |
| PubChem | 65036 |
| ChemSpider | 58548 |
| SMILES |
|
| InChI |
|
| InChIKey | JDLKFOPOAOFWQN-UHFFFAOYAO |
| Beilstein | 1752823 |
| EINECS | 208-727-7 |
| ChEBI | 28411 |
| KEGG | C07600 |
| MeSH | Allicin |
| IUPHAR配体 | 2419 |
| 性质 | |
| 化学式 | C6H10OS2 |
| 摩尔质量 | 162.28 g·mol⁻¹ |
| 密度 | 1.112 g/cm3(20/4℃) |
| 熔点 | <25 °C |
| 沸点 | 80~85 °C(0.2kPa,分解) |
| 折光度n D |
1.561 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
性质
大蒜素为淡黄色油状液体。具有强烈的大蒜臭、味辣。不溶于水,与乙醇、乙醚、苯、氯仿互溶。水溶液呈微酸性。对酸稳定,对热碱不稳定。蒸馏时分解。静置时有油状沉淀物产生。不稳定,23°C时可在16小时内分解。[6]
产生
一般认为,大蒜素的产生过程是大蒜粉碎后它所含的不稳定的蒜氨酸(1)经蒜氨酶分解为烯丙次磺酸(2)和脱氢丙氨酸(3),
然后不稳定的脱氢丙氨酸(3)立即分解为丙酮酸和氨,而两分子烯丙次磺酸(2)则歧化为烯丙亚磺酸(4)与烯丙硫醇(5),它们继续失水生成大蒜素(6):[9]
大蒜形成风味的机理与葱头十分相似,但粉碎过程中不会生成具有催泪性的中间体硫丙醛-S-氧化物。大蒜素对昆虫和微生物有一定的毒性,它的产生是大蒜抵挡昆虫进攻的自我防御机制。[10]
分解
大蒜素遇热分解为烯丙次磺酸(3)和烯丙硫醛(7),后者在常温下发生Diels-Alder反应,二聚成3-乙烯基-1,2-二硫杂-5-环己烯(8)和2-乙烯基-1,3-二硫杂-5-环己烯(9)等。[11]

大蒜素在水和油介质中的分解产物有二烯丙基硫醚(包括二烯丙基一硫醚、二烯丙基二硫醚、二烯丙基三硫醚、二烯丙基四硫醚等)、乙烯基二噻己烯和阿藿烯等:[12]

代谢
在体内很快被吸收。在血液中分解为烯丙硫醇(Allyl mercaptan)(2)。后被S-腺苷甲硫氨酸甲基化为甲基烯丙基硫醚(3),从肺中排出。
一般认为大部分烯丙硫醇会被氧化为烯丙磺酸,类似于从半胱氨酸到牛磺酸的转化过程。[12]
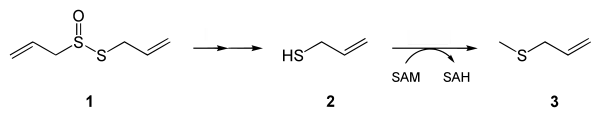
功效
一些动物试验和体外试验表明大蒜素有抗菌 页面存档备份,存于[13]、抗真菌[8]、消炎、抗氧化[14][15][16]、抗血栓[17]、降血压[18][19]、维持脂蛋白平衡、防治动脉硬化[20][21] 等功效。
一个2007年的临床试验结果是,对于胆固醇水平较高的病人,大蒜素不能降低血液胆固醇浓度。[22]
2009年,Vaidya、Ingold 和 Pratt 的研究表明大蒜素的生物功效主要是由大蒜素分解产生的2-丙烯次磺酸造成的,该化合物不稳定,很快便与体内的自由基发生反应使之失活。[23]
参见
- 二烯丙基二硫
- 二烯丙基三硫(大蒜新素)
参考资料
- https://onlinelibrary.wiley.com/doi/pdf/10.1111/j.1095-8339.2009.00996.x 页面存档备份,存于 2009年蒜隸屬的蔥亞科由《被子植物APG III分類法》併入石蒜科中,已不再屬於百合科。
- Eric Block. . Scientific American. 1985, 252 (March): 114–9. PMID 3975593. doi:10.1038/scientificamerican0385-114.
- An Introduction to Organosulfur Chemistry, R. J. Cremlyn, John Wiley and Sons: Chichester (1996). ISBN 0471955124.
- Eric Block, "Garlic and Other Alliums: The Lore and the Science" (Cambridge: Royal Society of Chemistry, 2010)
- Cremlyn, R. J. W. . Wiley. 1996. ISBN 0-471-95512-4.
- Hahn, G; in Koch HP, Lawson LD, eds. . Baltimore: Williams and Wilkins. 1996: 1–24.
- R. J. Cremlyn. . Chichester: John Wiley and Sons. 1996. ISBN 0-471-95512-4.
- Chester J. Cavallito, John Hays Bailey. . J. Am. Chem. Soc. 1944, 66 (11): 1950–1951. doi:10.1021/ja01239a048.
- A. Stoll, E. Seebeck. . Helv. Chim. Acta. 1949, 32 (1): 197–205. doi:10.1002/hlca.19490320129.
- . Phytochemicals. [2009-09-05]. (原始内容存档于2009-09-25).
- Calvey EM, Roach JA, Block E. . J. Chromatogr. Sci. 1994, 32 (3): 93–96.
- Theodor Dingermann (Hrsg.), Rudolf Hänsel (Hrsg.) und Ilse Zündorf (Hrsg.): Pharmazeutische Biologie: Molekulare Grundlagen und klinische Anwendungen. Springer Verlag Berlin; 1. Auflage 2002; ISBN 3-540-42844-5; S. 62f.
- Ankri, S; Mirelman D. . Microbes Infect. 1999, 2: 125–9.
- U. Sela, S. Ganor, I. Hecht, A. Brill, T. Miron, A. Rabinkov, M. Wilchek, D. Mirelman, O. Lider and R. Hershkoviz. . Immunology. 2004, 111: 391–399. doi:10.1111/j.0019-2805.2004.01841.x.
- Lindsey J. Macpherson, Bernhard H. Geierstanger, Veena Viswanath, Michael Bandell, Samer R. Eid, SunWook Hwang, and Ardem Patapoutian. . Current Biology. 2005, 15 (May 24): 929–934. 外部链接存在于
|title=(帮助) - Bautista DM, Movahed P, Hinman A, Axelsson HE, Sterner O, Hogestatt ED, Julius D, Jordt SE and Zygmunt PM. . Proc Natl Acad Sci USA. 2005, 102 (34): 12248–52. PMID 16103371. doi:10.1073/pnas.0505356102.
- Srivastava KC. . Prostaglandins Leukot Med. 1986, 22(3): 313–321. doi:10.1016/0262-1746(86)90142-3.
- Silagy CA, Neil HA. . J Hypertens. 1994, 12(4): 463–468.
- A. Elkayam, D. Mirelman, E. Peleg, M. Wilchek, T. Miron, A. Rabinkov, M. Oron-Herman and T. Rosenthal. . Am. J. Hypertens. 2003, 16: 1053–1056. doi:10.1016/j.amjhyper.2003.07.011.
- S. Eilat, Y. Oestraicher, A. Rabinkov, D. Ohad, D. Mirelman, A. Battler, M. Eldar and Z. Vered. . Coron. Artery Dis. 1995, 6: 985–990.
- D. Abramovitz, S. Gavri, D. Harats, H. Levkovitz, D. Mirelman, T. Miron, S. Eilat-Adar, A. Rabinkov, M. Wilchek, M. Eldar and Z. Vered,. . Coron. Artery Dis. 1999, 10: 515–519. doi:10.1097/00019501-199910000-00012.
- Gardner CD, Lawson LD, Block E; 等. . Arch. Intern. Med. 2007, 167 (4): 346–53. PMID 17325296. doi:10.1001/archinte.167.4.346.
- Vaidya, Vipraja; Keith U. Ingold, Derek A. Pratt. . Angewandte Chemie. 2009, 121 (1): 163–166 [21 Feb 2009]. doi:10.1002/ange.200804560.
- . 化工引擎. [2009-09-05]. (原始内容存档于2011-02-04).


