己内酰胺
己内酰胺(Caprolactam,簡稱CPL),化学式为(CH2)5C(O)NH的有机化合物,是6-氨基己酸(ε-氨基己酸)的内酰胺,也可看作己酸的环状酰胺。纯净的己内酰胺是白色的固体。其年产量大约45万吨。
| 己内酰胺 | |||
|---|---|---|---|
| |||
| IUPAC名 Azepan-2-one | |||
| 识别 | |||
| CAS号 | 105-60-2 | ||
| PubChem | 7768 | ||
| ChemSpider | 7480 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | JBKVHLHDHHXQEQ-UHFFFAOYAF | ||
| EINECS | 203-313-2 | ||
| ChEBI | 28579 | ||
| KEGG | C06593 | ||
| 性质 | |||
| 化学式 | C6H11NO | ||
| 摩尔质量 | 113.16 g·mol⁻¹ | ||
| 密度 | 1.01 g/cm3 | ||
| 熔点 | 69.2 °C(342 K) | ||
| 沸点 | 270.8 °C(544 K) | ||
| 溶解性(水) | 866.89 g/L (22 °C) | ||
| 蒸氣壓 | 8×10−8 mmHg (20° C)[1] | ||
| 危险性 | |||
| 警示术语 | R:R20, R22, R36/37/38 | ||
| 闪点 | 125 °C | ||
| 爆炸極限 | 1.4%-8.0%[1] | ||
| PEL | 无[1] | ||
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |||
生产
己内酰胺最早于19世纪后期通过ε-氨基己酸(己内酰胺的水解产物)的成环反应来制备。由于尼龙-6含有较大的商业价值,现在已有许多可用于生产己内酰胺的方法。
现在己内酰胺可由环己酮与硫酸羟胺发生成肟反应生成环己酮肟,再经酸处理发生贝克曼重排反应制得:
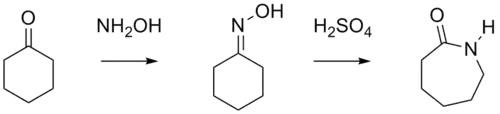 贝克曼重排
贝克曼重排
重排的直接产物是己内酰胺的硫酸氢盐,一般需要用氨中和以得到游离的己内酰胺,同时生成硫酸铵。
另一个主要的工业制备方法是通过亚硝酰氯使环己烷形成肟。该方法的优点是环己烷比环己酮价格更低廉。在较早的时代,也有通过用氨处理己内酯制备己内酰胺的方法。[2]
环己酮在叠氮酸在有硫酸或路易斯酸作催化剂的情况下反应的制备方法也曾得到报道。[3]
安全
己内酰胺具有刺激性,摄取、吸入或皮肤接触有毒,LD50为1.1 g/kg(大鼠,口服)。1991年,己内酰胺被列入1990年“美国清洁空气法案”的有害空气污染物清单,但于1996年被移除出名单。[4]
在国际癌症研究机构对致癌物质的分类中,己内酰胺被归为第4类致癌物“对人体基本无致癌作用”分类的唯一物质。[5]
目前,美国对于处理己内酰胺的工人暂未正式规定允许的接触限值。对于己内酰胺粉尘和蒸气,建议的长时间接触限值为1 mg/m3,短期接触限值为3 mg/m3。[6]
参见
- 氨基己酸
- 环己酮
- 尼龙6
参考资料
- NIOSH Pocket Guide to Chemical Hazards 0097
- Josef Ritz; Hugo Fuchs; Heinz Kieczka; William C. Moran, , , Weinheim: Wiley-VCH, 2005, doi:10.1002/14356007.a05_031.pub2
- Eric J. Kantorowski; Mark J. Kurth. (PDF). Davis: University of California. 2000-01-03 [2017-07-24]. (原始内容 (PDF)存档于2017-08-10) (英语).
- EPA - Modifications To The 112(b)1 Hazardous Air Pollutants
- (PDF). IARC. 2016-02-22 [2016-10-21].
- , CDC, [2013-08-11]
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.



