拉帕替尼
拉帕替尼()是由葛蘭素史克所研發製造的抗癌藥物,於2007年3月13日由美國食品藥物管理局所核准上市。目前核准的適應症為與卡培他滨(Capecitabine)合併治療晚期或是轉移性乳癌,而乳癌患者必須以先經過其他第一線藥物治療且失敗。其在美國的商品名為,而在歐洲一旦經由歐洲管理單位通過核准之後將會已為商品名。
 | |
| 系统(IUPAC)命名名称 | |
|---|---|
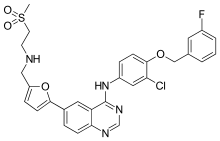
N-[3-chloro-4-[(3-fluorophenyl)methoxy]phenyl]-6- [5-[(2-methylsulfonylethylamino)methyl]-2-furyl] quinazolin-4-amine | |
| 临床数据 | |
| 妊娠分级 |
|
| 给药途径 | 口服 |
| 合法狀態 | |
| 合法状态 |
|
| 药代动力学数据 | |
| 蛋白结合度 | 99% |
| 代谢 | 肝臟CYP450酵素系統 |
| 生物半衰期 | 24小時 |
| 排泄 | 糞便排泄 |
| 识别 | |
| CAS注册号 | 388082-78-8((ditosylate)) 231277-92-2 |
| ATC代码 | L01XE07 |
| PubChem | CID 208908 CID 208908 |
| IUPHAR/BPS | 5692 |
| DrugBank | DB01259 |
| ChemSpider | 181006 |
| UNII | 0VUA21238F |
| KEGG | D04024 |
| ChEBI | CHEBI:49603 |
| ChEMBL | CHEMBL554 |
| 化学 | |
| 化学式 | C29H26ClFN4O4S |
| 摩尔质量 | 581.058 g/mol |
拉帕替尼的特殊性在於已經接受過其他化療藥物治療的病患並不會對其產生交叉抗藥性,以及可以有效的減緩乳癌的疾病進展。目前還有許多其他臨床實驗正在進行以研究拉帕替尼對於其他癌症的治療效果。
藥理
拉帕替尼為酪胺酸激酶抑制劑(Tyrosine Kinase Inhibitor),主要作用於上皮細胞生長因子受體(Epidermal Growth Factor Receptor,EGFR)。EGFR對癌細胞的生長有重要的影響與控制相關性。如果癌細胞的受體過度表現或是過度活化,那癌細胞將會大量生長,因而連帶地增加治癒困難度以及再發的機率。EGFR受體可分為四種人類上皮生長因子受體(Human Epidermal Receptor)。第一型通常稱為EGFR,而第二型則稱為HER2,其他另有第三與第四型。在這四型中,第二型受體的存在與否最為重要,因為第二型受體的過度表現與過度活化與乳癌患者的治癒機率成反比,即患者的癌細胞若帶有第二型受體,那麼其治癒率則越低,復發率越高,預計生存時間越短。[1]
拉帕替尼除了阻斷第一型受體(EGFR)之外,亦有阻斷第二型受體(HER2)的作用,這個雙重抑制效用可以有效的截斷酪胺酸激酶對其下游信號傳遞,進而終止癌細胞的快速增生。大約20至30%的乳癌病患有第一及第二型受體過度表現,因此拉帕替尼可以有效的減緩癌症的進展。
另一種與拉帕替尼相似的癌症治療藥物為trastuzumab。Trastuzumab與拉帕替尼相似處為兩者皆可阻斷EGFR家族下的第一型與第二型受體,但是拉帕替尼的作用原理與trastuzumab有幾點稍微的不同。EGFR受體存在於細胞外與細胞內,trastuzumab只能阻斷細胞外的受體,而拉帕替尼則可以阻斷細胞內外的受體。EGFR受體中的截短型(truncated)受體只位於細胞內,所以拉帕替尼可以有效的阻斷這一類型的受體,而截短型受體又較一般型受體具有更強的活性。這兩點使得具有雙重抑制作用的拉帕替尼比像trastuzumab般的單一抑制劑有更大的功效,並且可以避免交叉抗藥性。
有研究顯示使用trastuzumab治療乳癌的病患有較高的癌症轉移至腦部的機率,這點可能是因為腦血管障壁阻擋了較大分子的trastuzumab進入腦部所導致的[2]。而拉帕替尼的小分子特性則能夠使之穿越腦血管障壁,進而治療轉移性腦腫瘤[3][4]。
藥物動力學
拉帕替尼的口服吸收比例並不完全並且有多變動性,約於15分鐘後即可在血液中檢測出存在濃度,有效半衰期為24小時,並在6-7天內可達到穩定血中濃度。相同劑量若分多次給予會產生單次給予的全身性暴露量的兩倍。食物會影響拉帕替尼的吸收,尤其是與含有脂肪的食物並服時會導致三到四倍的全身性暴露量,因此此藥應該與食物間隔至少兩小時才服用。
拉帕替尼會高度地與血中的蛋白結合,與白蛋白(albumin)及a-1酸醣蛋白(alpha-1 acid glycoprotein)結合率超過99%。
拉帕替尼主要由肝臟的CYP系統代謝,其中以3A4以及3A5酵素為主,2C19與2C8為次要。這使得在使用拉帕替尼時必須要注意病患的肝功能,以及其他使用同一酵素代謝的藥物之間的交互作用,這可能導致拉帕替尼的劑量需要增加或減少。
拉帕替尼主要是由糞便排出人體外,經由腎臟所排出的部份不到2%,因此腎功能低落的病患可以安全的使用此藥。
在老年病患中的使用與一般病患無異。尚未有研究針對小兒病患的使用。
劑量與用法
目前上市的拉帕替尼為250毫克口服錠劑。美國食品藥物管理局核准的服方為拉帕替尼與capecitabine合併服用。拉帕替尼的建議劑量為每日服用1250毫克(五錠),並持續21天為一療程。Capecitabine口服劑量為每日服用每身體表平方公尺面積2000毫克的劑量,並持續28天為一療程。
其最常見之副作用為腸胃消化道系統方面的副作用,即是噁心、嘔吐、腹瀉等症狀,其他還有皮膚方面的紅腫、搔癢、疼痛,以及疲倦等。另外還有極少見但是嚴重的副作用,包括心臟方面以及肺部方面。
當病患出現二級(New York Heart Association,NYHA class 2)以上的心臟左心室搏出分率(Left Ventricle Ejection Fraction,LVEF)下降時,必須停止使用,以避免產生心臟衰竭。當LVEF回復至正常值或病患無症狀後兩個禮拜便可以以較低劑量重新用藥。與anthracycline類的化療藥品相比,拉帕替尼的心臟毒性為可逆的,不像anthracycline的不可逆性並有一生最多使用量,拉帕替尼並沒有一生最多使用量。
由於拉帕替尼是以肝臟CYP酵素系統代謝的藥物,在使用其他具有誘導或是抑制CYP酵素的藥物時,必須要注意劑量的調整。孕婦一般不應該使用拉帕替尼,因為其懷孕毒性分類為D,因此如果沒有絕對的需要或是對母體有極大的利益,否則不建議孕婦或育懷孕者使用。
参考資料
- . Geyer CE, Forster J, Lindquist D et al. Lapatinib plus capecitabine for HER2-positive advanced breast cancer. N Engl J Med 2006;355:2733-43.
- . Lindley C, Michaud LB. Breast Cancer. In: DiPiro JT et al. Eds. Pharmacotherapy: A Pathophysiologic approach, 6th Ed. New York: McGraw-Hill. 2005:2329-64. ISBN 0-07-141613-7
- . Tykerb (lapatinib) [product information]. Research Triangle Park, NC: GlaxoSmithKline, August, 2007.
- . 許銘偉 藥師; 林逸祥 藥師. . 2007年12月7日 [2008年4月28日].
- . 蕭雅尤. 抗癌新藥 - Tykerb?(Lapatinib). 藥學雜誌 The Journal of Pharmacy. 2008年3月31日, 24 (1): 55-60. ISSN 1011-7806. 于2008年4月28日查閱.
注釋
- Ross JS, Fletcher JA, Linette GP; 等. . Oncologist. 2003, 8 (4): 307–25. PMID 12897328.
- Weitzen R, Zach L, Kaufman B, et al. High incidence of brain metastasis (BM) in patients on trastuzumab (H) for advanced breast cancer. Proc Am Soc Clin Oncol. 2002; 21:1936.
- Stemmler J, Kahlert S, Siekiera W, et al. Brain metastases (MB) in patients trated with trastuzumab for HER-2 overexpressing metastatic breast cancer (MBC): incidnece and survivial. J Clin Oncol. 2005; 23 (Suppl 16):1568.
- Stemmler J, Schmiit M, Willems A, et al. Brain metastases in HER-w overexpressing metastatic breast cnacer: comparative analysis of tratuzumablevels in serum and cerebrospinal fluid. J Clin Oncol. 2006; 24 (Suppl 18):1525.
