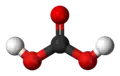
碳酸
碳酸(英語:),原來也稱揮發酸(Volatile acid)和呼吸酸(Respiratory acid),[1] 化學式為H2CO3,是酸的一種。二氧化碳()溶於水後,一部分二氧化碳會與水化合,形成碳酸。該反應是一個可逆反應,[2]方程式如下:
| 碳酸 | |||
|---|---|---|---|
| |||
| IUPAC名 Carbonic acid | |||
| 别名 | 二氧化碳水溶液; 碳酸氢; 羟基甲酸 | ||
| 识别 | |||
| CAS号 | 463-79-6 | ||
| ChemSpider | 747 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | BVKZGUZCCUSVTD-UHFFFAOYAU | ||
| ChEBI | 28976 | ||
| KEGG | C01353 | ||
| 性质 | |||
| 化学式 | H2CO3 | ||
| 摩尔质量 | 62.03 g/mol g·mol⁻¹ | ||
| 外观 | 無色水溶液 | ||
| 密度 | 1.668 g/cm3 | ||
| 溶解性(水) | 只存在水溶液中 | ||
| pKa | 6.367 (pKa1), 10.32 (pKa2) | ||
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |||
該反應在常溫下的平衡常數是Kh=1.70×10−3;因此大部分二氧化碳都不會參與反應。假若沒有催化劑存在,反應速率十分緩慢,其反應速率常數僅為0.039 s−1(正反應)以及23 s−1(逆反應)。
碳酸是无机物。
生物体内的碳酸
碳酸的酸性
-
- Ka1 = 4.3×10-7 mol/L; pKa1 = 6.37 (25 °C)
-
- Ka2 = 4.8×10-11 mol/L; pKa2 = 10.32 (25 °C)
需要注意的是,以上所述值並不適用於實際估算碳酸的酸性,因為單個碳酸分子的酸性比醋酸和甲酸都要強。但實際上,碳酸分子只出現在二氧化碳和水的動態平衡中,其濃度比二氧化碳低得多,故酸度實際上較低,第一步反應可以記作:
-
- Ka = 4.30×10-7 mol/L; pKa = 6.36
這個值被稱為碳酸的解離常數。
参考文献
- Acid-Base Physiology 2.1 - Acid-Base Balance 页面存档备份,存于 by Kerry Brandis
- Greenwood, Norman N.; Earnshaw, Alan., 2nd, Oxford: Butterworth-Heinemann: 310, 1997, ISBN 0080379419
- "excretion." Encyclopædia Britannica. Encyclopædia Britannica Ultimate Reference Suite. Chicago: Encyclopædia Britannica, 2010.
- Badger MR, Price GD. . Annu. Rev. Plant Physiol. Plant Mol. Bio. 1994, 45: 369–392. doi:10.1146/annurev.pp.45.060194.002101.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.