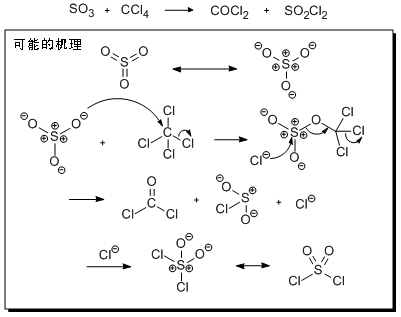
光气
碳酰氯,俗稱光成气(英語:;化学式:COCl2),簡稱光气,从化学结构上看是碳酸的二酰氯衍生物,是非常活泼的亲电试剂,容易水解,是剧烈窒息性毒气,高浓度吸入可致肺水肿,毒性比氯气约大10倍,但在体内无蓄积作用。其俗名譯自希臘文φως(光)+Γίνει(產生)。光气最初是由氯仿受光照分解产生,故有此名。
| 光气 | |
|---|---|
 | |
 | |
 | |
| IUPAC名 Carbonyl chloride | |
| 别名 | 碳酰氯、碳酰二氯、二氯甲醛、氧氯化碳、氯甲酰氯、氯化羰基、二氯化羰 |
| 识别 | |
| CAS号 | 75-44-5 |
| PubChem | 6371 |
| ChemSpider | 6131 |
| SMILES |
|
| InChI |
|
| InChIKey | YGYAWVDWMABLBF-UHFFFAOYAH |
| UN编号 | 1076 |
| EINECS | 200-870-3 |
| ChEBI | 29365 |
| RTECS | SY5600000 |
| 性质 | |
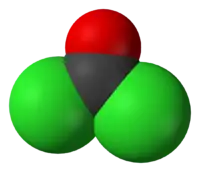
| 化学式 | CCl2O |
| 摩尔质量 | 98.9 g·mol⁻¹ |
| 外观 | 无色气体 |
| 密度 | 4.248 g/L |
| 熔点 | −118 °C (155 K) |
| 沸点 | 8 °C (281 K) |
| 溶解性(水) | 可水解 |
| 结构 | |
| 分子构型 | 平面 |
| 偶极矩 | 1.17 D |
| 危险性 | |
欧盟危险性符号 剧毒 T+ 剧毒 T+ | |
| 警示术语 | R:R26-R34 |
| 安全术语 | S:S1/2-S9-S26-S36/37/39-S45 |
| MSDS | |
| NFPA 704 |
 0
4
1
|
| 闪点 | 不可燃 |
| 相关物质 | |
| 相关化学品 | 碳酸、尿素、 一氧化碳、氯甲酸 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
历史
光气的诞生是由化学家John Davy(1790-1868)在1812年合成的。
起初光气被当作一种化学武器而被德国军队在第一次世界大战中使用,人体吸入光气会因為與肺中的蛋白質產生反應,導致肺充滿液體,可能因而造成肺气肿。碱性物质可以用来消除光气的毒性。随后在第二次世界大战中,光气作为化学武器,被很多军队广泛使用。其中日本軍曾在侵华战争中使用过光气。
生产与制备
其他
英文phosgene(phos光+gen產生)其中phos的字根是photo。產生(generate):gene-ra-ate。其中gene字根的意思是birth、produce、beget,ate在字根的意義上是(v.)動詞。
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.