二氯化二硫
| 二氯化二硫 | |
|---|---|
 | |
 | |
 | |
| IUPAC名 Disulfur dichloride Dichlorodisulfane Bis[chloridosulfur](S–S) | |
| 别名 | 一氯化硫 氯化硫 |
| 识别 | |
| CAS号 | 85408-26-0((isobutenate)) 10025-67-9 |
| PubChem | 24807 |
| ChemSpider | 23192, 19158348 (isobutenate) |
| SMILES |
|
| InChI |
|
| InChIKey | PXJJSXABGXMUSU-UHFFFAOYAK |
| UN编号 | 3390 |
| EINECS | 233-036-2 |
| RTECS | WS4300000 |
| MeSH | Sulfur+monochloride |
| 性质 | |
| 化学式 | S2Cl2 |
| 摩尔质量 | 135.04 g·mol⁻¹ |
| 外观 | 黄色至橙色透明有恶臭液体 |
| 密度 | 1.688 g/cm3 |
| 熔点 | –80 °C |
| 沸点 | 137.1 °C |
| 溶解性(水) | 遇水反应,放出氯化氢 |
| 溶解性(其他) | 溶于乙醇、苯、乙醚、氯仿、四氯化碳[1] |
| 蒸氣壓 | 15 hPa (20 °C)[2] |
| 折光度n D |
1.658 (20 °C) |
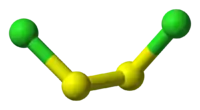
| 结构 | |
| 配位几何 | 折线形 |
| 偶极矩 | 1.60 D[1] |
| 危险性 | |
| 警示术语 | R:R14, R20, R25, R29, R35, R50 |
| 安全术语 | S:S1/2, S26, S36/37/39, S45, S61 |
| MSDS | ICSC 0958 |
| 欧盟编号 | 016-012-00-4 |
| 欧盟分类 | 有毒 (T) 有害 (Xn) 腐蚀性 (C) 对环境有害 (N) |
| NFPA 704 |
 1
2
1
|
| 闪点 | 118.5 °C |
| 自燃温度 | 234 °C |
| 相关物质 | |
| 相关硫的氯化物 | 二氯化硫 氯化亚砜 硫酰氯 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
二氯化二硫,有時亦作一氯化硫,化学式S2Cl2。
结构
二氯化二硫分子为折线型结构,形似一本打开的书,与双氧水类似,为偏转构象(gauche)。它有一种结构式为 S=SCl2 异构体,可在二氯化二硫受到紫外辐射时生成,不过寿命很短。
参考资料
- Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0070494398
- Record of Dischwefeldichlorid in the GESTIS Substance Database from the IFA
- 中国化工产品大全 上卷,Bc115 一氯化硫,页125
| 维基共享资源中相关的多媒体资源:二氯化二硫 |
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
