二茂铑
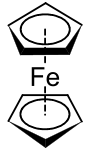
二茂铑(英語:),也称双(η5-环戊二烯基)合铑(II),分子式为[Rh(C5H5)2]。分子由两个η5的环戊二烯配体(哈普托数为5,表示环戊二烯基有五个原子参与配位)和一个铑原子构成,铑原子处在平行的两个环戊二烯基中间形成“三明治”夹心结构。由于二茂铑的价电子数为19,根据18电子规则判断它在室温下是不稳定的并且具有类似自由基的性质。实验获得的事实也已经证实了这点。二茂铑能存在于大于150°C的温度下,可利用液氮(−196°C)急速冷却的方法捕获到它。室温下,两个二茂铑分子的环戊二烯基会键合形成黄色的二聚体。[1][2][3]
| 二茂铑 | |
|---|---|
 | |
| 别名 | 双环戊二烯铑 |
| 识别 | |
| CAS号 | 12318-21-7 |
| ChemSpider | 2339512 |
| SMILES |
|
| 性质 | |
| 化学式 | C10H10Rh |
| 摩尔质量 | 233.09 g·mol−1 |
| 外观 | 黄色固体(二聚物)[1] |
| 熔点 | 174℃分解(二聚物)[1] |
| 溶解性(水) | 稍溶于二氯甲烷(二聚物)[1] 溶于乙腈[1] |
| 相关物质 | |
| 相关化学品 | 二茂铁 二茂钴 二茂铱 二茂钌 二苯铬 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
有机金属化学的历史可以追溯到在19世纪发现的蔡斯盐[4][5]和路德维希·蒙德发现的四羰基镍[6]。由于当时化学家所理解的化学键模型不适用于解释这些化合物,因此这些化合物的出现对化学家提出了挑战。进一步的挑战出现在像二茂铁[7] 、二茂铑这类茂金属化合物被发现之后[8]。当时出乎意料的是,诸如二茂铁和与其有相似化学结构的[Rh(C5H5)2]+[注释 1]、[Co(C5H5)2]+、[Ir(C5H5)2]+都有比较稳定的化学性质。[10][9]对包括这些化合物在内的有机金属化学的研究催生出了新的化学键模型,以便合理解释这些有机金属化合物的形成和稳定性。[11][12]基于杰弗里·威尔金森和恩斯特·奥托·菲舍尔对夹心茂金属化合物研究所做出的杰出贡献,两人在1977年被授予诺贝尔化学奖。[13]
因为[Rh(C5H5)2]+的盐比较稳定也容易合成,所以通常用它作为原料合成不稳定的二茂铑和含有取代基的二茂铑。最初的合成方法是用环戊二烯基阴离子和乙酰丙酮铑(III)反应,之后又开发出了多种其它的合成方法,包括气相氧化还原转移金属化[14]和使用半三明治结构的前躯体[15]等。八苯基取代的二茂铑尽管会在空气下迅速分解,但它是第一个在室温下分离得到的带取代基的二茂铑化合物。X射线晶体学的研究显示八苯基二茂铑具有交错构象的三明治夹心结构。[16]不同于能作为单电子还原剂使用的二茂钴,[17]迄今为止还未发现兼具还原性和足够稳定性的二茂铑衍生物。
生物医学方面,研究人员已经考察过二茂铑及其衍生物在医疗领域的用途[18]并报道了一例将二茂铑衍生物作为放射性药剂治疗小癌症的应用。[19][20]二茂铑的衍生物也可用于合成由多个茂金属连接而成的化合物。通过研究这类化合物可以了解金属与金属之间的相互作用[21],在分子电子学和催化机理的研究中有潜在的应用。[22]研究二茂铑所能获得的价值与其说是在于它的直接应用,倒不如说是在于它为深入研究化学键和反应动力学提供了新体系。
历史
1831年发现的蔡斯盐K[PtCl3(C2H4)]·H2O[5]和1888年由蒙德发现的Ni(CO)4[24]作为有机金属化学的开端,使化学家开始深入理解化学键。蔡斯盐中的乙烯和四羰基镍中的一氧化碳作为小分子能与中心的金属原子形成化学键。[4] 蔡斯盐阴离子的空间填充模型(左图)显示[23] 在作为中心原子的金属[铂]](图中的蓝色部分)和乙烯配体的碳原子(图中的黑色部分)之间存在直接的键合作用,这种金属-碳键就是有机金属化合物的定义性特征。但是,当时的化学键模型不能解释这种金属-烯烃键的本质。直到二十世纪五十年代,Dewar–Chatt–Duncanson模型的提出才解决了这个问题。[11]这个模型最初只涵盖了金属-烯烃键[24],但随着时间的推移模型的适用范围扩大覆盖到了像金属羰基配合物(包括四羰基镍)这类具有重要的反馈π键的金属有机化合物。[25]
1951年Kealy和Pauson尝试利用环戊二烯氧化偶联合成富瓦烯,结果得到了分子式为C10H10Fe化合物,它表现出非常稳定的化学性质,这是第一次对二茂铁[Fe(C5H5)2]的合成。[10]这一发现在有机金属化学界引起了极大的兴趣[7][8],部分原因在于Pauson和Kealy提出的二茂铁结构与现有的化学键模型不一致,不能用这个模型结构解释二茂铁出乎意料的稳定性。因此最初研究二茂铁时的挑战在于最终确定二茂铁的分子结构以期能对其化学键和性质能有所了解。1952年三个独立的研究小组分别推断出二茂铁的分子结构:罗伯特·伯恩斯·伍德沃德和杰弗里·威尔金森发现二茂铁的反应性类似于一些典型的芳香族分子(比如苯)[26],通过对二茂铁反应性的研究推断出它的分子结构[27];恩斯特·奥托·菲舍尔不仅推断出了二茂铁的三明治夹心结构而且开始合成包括二茂钴在内的其他茂金属化合物[28];艾兰和佩宾斯基在X射线晶体学上确认了二茂铁的三明治结构[29]。
二茂铑的合成方法
[Rh(C5H5)2]+的盐是在发现二茂铁的两年后被首次合成和报道出来的[9][10]。这些盐是通过含碳负离子的格氏试剂环戊二烯基溴化镁(C5H5MgBr)和乙酰丙酮铑(Ⅲ)(Rh(acac)3)反应得到的。后来发现了Rh+和二茂铁或二茂镍在气态下发生氧化还原转移金属化反应合成气态[Rh(C5H5)2]+的方法。[14]
- Rh+ + [(η5-C5H5)2M] → M + [(η5-C5H5)2Rh]+ M = Ni or Fe
[Rh(C5H5)2]+的盐也可用微波合成法制备。[30]以甲醇为溶剂,将环戊二烯和水合三氯化铑的混合溶液置于微波下辐照30秒后用六氟磷酸铵的甲醇溶液淬灭,能以超过60%的产率得到二茂铑的六氟磷酸盐。[31]
- RhCl3.xH2O + 2 C5H6 + NH4PF6 → [(η5-C5H5)2Rh]PF6 + 2 HCl + NH4Cl + xH2O
用熔融的单质钠还原二茂铑的盐能得到二茂铑。[2]如果先将钠或钾单质与熔融的二茂铑盐反应,接着升华入一个用液氮冷却的冷指中会生成一种黑色的多晶状物质。[32]将它加热至室温后会产生一种黄色固体,该物质已被确认为二茂铑的二聚体。类似的方法也可用于二茂铱二聚体的合成。[32]
取代基二茂铑和二茂铑盐
[(η5-C5tBu3H2)Rh(η5-C5H5)]+阳离子
带有取代基的环戊二烯基配合物可通过乙烯基取代的环丙烯为原料来合成。[33][34][35] 利用乙烯基环丙烷发生重排扩环反应合成环戊烯的方法已广为人所知[36],据此衍生开发了利用乙烯基环丙烯重排扩环合成环戊二烯的方法。[(η5-C5tBu3H2)Rh(η5-C5H5)]+阳离子就是通过这种方法合成的,先将一氯二乙烯合铑(Ⅰ)的二聚体[(η2-C2H4)2Rh(μ-Cl)]2加入到1,2,3-三叔丁基-3-乙烯基-1-环丙烯中反应,随后向反应体系中加入环戊二烯基铊得到产物:[33][34]
这个反应生成的是18个价电子的戊二烯铑(Ⅲ)物种而非二茂铑再次说明了二茂铑的不稳定性,将戊二烯铑(Ⅲ)物种在甲苯中加热回流数月后仍没有1,2,3-三叔丁基二茂铑(Ⅱ)形成但在氧化性条件戊二烯铑(Ⅲ)物种迅速形成[(η5-C5tBu3H2)Rh(η5-C5H5)]+。[33]用循环伏安法研究反应的机理发现[33][34],这反应过程中戊二烯铑(Ⅱ)先失去一个电子形成戊二烯铑(Ⅲ)的阳离子,随后快速重排(失去一个氢原子)形成[(η5-C5tBu3H2)Rh(η5-C5H5)]+。[34]通过X射线晶体学的分析确认了[(η5-C5tBu3H2)Rh(η5-C5H5)]+的四氟硼酸盐和六氟磷酸盐的结构。[34]
参考资料
- El Murr, N.; Sheats, J. E.; Geiger, W. E.; Holloway, J. D. L. . Inorg. Chem. 1979, 18 (6): 1443–1446. doi:10.1021/ic50196a007.(英文)
- Fischer, E. O.; Wawersik, H. . J. Organomet. Chem. 1966, 5 (6): 559–567. doi:10.1016/S0022-328X(00)85160-8 (德语).
- Keller, H. J.; Wawersik, H. . J. Organomet. Chem. 1967, 8 (1): 185–188. doi:10.1016/S0022-328X(00)84718-X (德语).
- Hunt, L. B. (PDF). Platinum Metals Rev. 1984, 28 (2): 76–83 [2012-09-09]. (原始内容存档 (PDF)于2015-09-24).
- Zeise, W. C. . Ann. der Physik. 1831, 97 (4): 497–541. Bibcode:1831AnP....97..497Z. doi:10.1002/andp.18310970402 (德语).
- Crabtree, R. H. 5th. Hoboken, NJ: John Wiley and Sons. 2009: 2 [2012-09-09]. ISBN 978-0-470-25762-3. (原始内容存档于2015-05-10).
An industrial application of transition metal organometallic chemistry appeared as early as the 1880s, when Ludwig Mond showed that nickel can be purified by using CO to pick up nickel in the form of gaseous Ni(CO)4 that can easily be separated from solid impurities and later be thermally decomposed to give pure nickel.
... Recent work has shown the existence of a growing class of metalloenzymes having organometallic ligand environments – considered as the chemistry of metal ions having C-donor ligands such as CO or the methyl group
- Laszlo, P.; Hoffmann, R. . Angew. Chem. Int. Ed. 2000, 39 (1): 123–124. PMID 10649350. doi:10.1002/(SICI)1521-3773(20000103)39:1<123::AID-ANIE123>3.0.CO;2-Z.
- Federman Neto, A.; Pelegrino, A. C.; Darin, V. A. . ChemInform. 2004, 35 (43). doi:10.1002/chin.200443242. (Abstract; original published in Trends Organomet. Chem., 4:147–169, 2002)
- Cotton, F. A.; Whipple, R. O.; Wilkinson, G. . J. Am. Chem. Soc. 1953, 75 (14): 3586–3587. doi:10.1021/ja01110a504.
- Kealy, T. J.; Pauson, P. L. . Nature. 1951, 168 (4285): 1039–1040. Bibcode:1951Natur.168.1039K. doi:10.1038/1681039b0.
- Mingos, D. M. P. . J. Organomet. Chem. 2001, 635 (1–2): 1–8. doi:10.1016/S0022-328X(01)01155-X.
- Mehrotra, R. C.; Singh, A. 2nd. New Delhi: New Age International. 2007: 261–267 [2012-09-09]. ISBN 978-81-224-1258-1. (原始内容存档于2015-05-10).
- . Nobel Foundation. [12 September 2010]. (原始内容存档于2012-10-26).
- Jacobson, D. B.; Byrd, G. D.; Freiser, B. S. . J. Am. Chem. Soc. 1982, 104 (8): 2320–2321. doi:10.1021/ja00372a041.
- He, H. T. (PhD thesis). University of Sydney. 1999. OCLC 222646266.
- Collins, J. E.; Castellani, M. P.; Rheingold, A. L.; Miller, E. J.; Geiger, W. E.; Rieger, A. L.; Rieger, P. H. . Organometallics. 1995, 14 (3): 1232–1238. doi:10.1021/om00003a025.
- Connelly, N. G.; Geiger, W. E. . Chem. Rev. 1996, 96 (2): 877–910. PMID 11848774. doi:10.1021/cr940053x.
- Pruchnik, F. P. . Gielen, M.; Tiekink, E. R. T (编). . Hoboken, NJ: Wiley. 2005: 379–398 [2012-09-09]. ISBN 0-470-86403-6. doi:10.1002/0470864052.ch20. (原始内容存档于2015-05-10).
- Wenzel, M.; Wu, Y. . Int. J. Rad. Appl. Instrum. A. 1988, 39 (12): 1237–1241. PMID 2851003. doi:10.1016/0883-2889(88)90106-2 (德语).
- Wenzel, M.; Wu, Y. F. . Int. J. Rad. Appl. Instrum. A. 1987, 38 (1): 67–69. PMID 3030970. doi:10.1016/0883-2889(87)90240-1 (德语).
- Barlow, S.; O'Hare, D. . Chem. Rev. 1997, 97 (3): 637–670. doi:10.1021/cr960083v.
- Wagner, M. . Angew. Chem. Int. Ed. 2006, 45 (36): 5916–5918. doi:10.1002/anie.200601787.
- Jarvis, J. A. J.; Kilbourn, B. T.; Owston, P. G. . Acta Cryst. B. 1971, 27 (2): 366–372. doi:10.1107/S0567740871002231.
- Leigh, G. J.; Winterton, N. (编). . . Cambridge, UK: RSC Publishing. 2002: 101–110 [2012-09-09]. ISBN 0-85404-469-8. (原始内容存档于2015-05-10).
- Astruc, D. . Berlin: Springer. 2007: 41–43 [2012-09-09]. ISBN 978-3-540-46128-9. (原始内容存档于2015-05-10).
- Werner, H. . New York: Springer Science. 2008: 161–163 [2012-09-09]. ISBN 978-0-387-09847-0. (原始内容存档于2015-05-10).
- Wilkinson, G.; Rosenblum, M.; Whiting, M. C.; Woodward, R. B. . J. Am. Chem. Soc. 1952, 74 (8): 2125–2126. doi:10.1021/ja01128a527.
- Fischer, E. O.; Pfab, W. . Z. Anorg. Allg. Chem. 1952, 7 (6): 377–379. doi:10.1002/zaac.19532740603 (德语).
- Eiland, P. F.; Pepinsky, R. . J. Am. Chem. Soc. 1952, 74 (19): 4971. doi:10.1021/ja01139a527.
- Baghurst, D. R.; Mingos, D. M. P. . J. Organomet. Chem. 1990, 384 (3): C57–C60. doi:10.1016/0022-328X(90)87135-Z.
- Baghurst, D. R.; Mingos, D. M. P.; Watson, M. J. . J. Organomet. Chem. 1989, 368 (3): C43–C45. doi:10.1016/0022-328X(89)85418-X.
- De Bruin, B.; Hetterscheid, D. G. H.; Koekkoek, A. J. J.; Grützmacher, H. . Prog. Inorg. Chem. 2007, 55: 247–354 [2012-09-09]. ISBN 978-0-471-68242-4. doi:10.1002/9780470144428.ch5. (原始内容存档于2015-05-10).
- Donovan-Merkert, B. T.; Tjiong, H. I.; Rhinehart, L. M.; Russell, R. A.; Malik, J. . Organometallics. 1997, 16 (5): 819–821. doi:10.1021/om9608871.
- Donovan-Merkert, B. T.; Clontz, C. R.; Rhinehart, L. M.; Tjiong, H. I.; Carlin, C. M.; Cundari, Thomas R.; Rheingold, Arnold L.; Guzei, Ilia. . Organometallics. 1998, 17 (9): 1716–1724. doi:10.1021/om9707735.
- Hughes, R. P.; Trujillo, H. A.; Egan, J. W.; Rheingold, A. L. . Organometallics. 1999, 18 (15): 2766–2772. doi:10.1021/om990159o.
- Goldschmidt, Z.; Crammer, B. . Chem. Soc. Rev. 1988, 17: 229–267. doi:10.1039/CS9881700229.


Rh(C5H5))BF4.svg.png.webp)
