噻吩
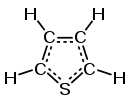
噻吩[註 1](英語:),系统名1-硫杂-2,4-环戊二烯,CAS号110-02-1。从结构式上看,噻吩是一种杂环化合物,也是一种硫醚。分子式C4H4S,分子量84.14。熔点-38℃,沸点84℃,密度1.051g/cm3。
| 噻吩 | |||
|---|---|---|---|
| |||
 | |||
 | |||
| IUPAC名 Thiophene | |||
| 别名 | Thiofuran Thiacyclopentadiene | ||
| 识别 | |||
| CAS号 | 110-02-1 | ||
| PubChem | 8030 | ||
| ChemSpider | 7739 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | YTPLMLYBLZKORZ-UHFFFAOYAY | ||
| ChEBI | 30856 | ||
| RTECS | XM7350000 | ||
| 性质 | |||
| 化学式 | C4H4S | ||
| 摩尔质量 | 84.14 g·mol⁻¹ | ||
| 外观 | 無色液體 | ||
| 密度 | 1.051 | ||
| 熔点 | −38 °C | ||
| 沸点 | 84 °C | ||
| 折光度n D |
1.5287 | ||
| 黏度 | 8.712 cP (0.2 °C) 6.432 cP (22.4 °C) | ||
| 危险性 | |||
| MSDS | External MSDS | ||
| 欧盟分类 | 未列明 | ||
| NFPA 704 |
 3
2
0
| ||
| 闪点 | −1 °C | ||
| 相关物质 | |||
| 相关的硫醚 | 四氫噻吩 乙硫醚 | ||
| 相关化学品 | 呋喃 吡咯 | ||
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |||
发现与存在
噻吩最初是作为苯的杂质而发现的。[1]靛红与硫酸、粗苯混合形成一种蓝色染料,早期认为这是苯的反应,直到德国化学家维克托·梅耶分离出噻吩,才发现了这种杂环化合物的存在。[2]噻吩天然存在于石油、煤焦油和页岩油中,在石油中含量可高达数个百分点,所以石油精炼中必须脱硫,以减少二氧化硫污染物的排放。由于噻吩沸点与苯接近,煤焦油分馏得到的粗苯中含约0.5%的噻吩且不能通过分馏除去。
性质
噻吩与苯相似,具有芳香性。其硫原子2对孤电子中的一对与2个双键共轭,形成离域Π键,噻吩的芳香性仅略弱于苯,比呋喃和吡咯稳定,这是C-S键键长较长,缓解了环张力的缘故。[3]其比苯更容易发生亲电取代反应,主要取代在2位上。噻吩2位上的氢也很容易被金属取代 ,生成汞和钠等的衍生物。噻吩环系对氧化剂具有一定的稳定性,例如,烷基取代的噻吩氧化后可以形成噻吩羧酸。用金属钠在液氨和甲醇溶液内还原噻吩,可得二氢噻吩,以及某些开环化合物。用催化氢化法还原噻吩,可得四氢噻吩。在兰尼镍催化下氢化,噻吩能最终脱硫生成丁烷。
合成
工业上噻吩用丁烷与硫作用制取。或由二硫化碳和丁醇在500-550℃,氧化物催化剂作用下得到。[5]实验室中用1,4-二羰基化合物与三硫化二磷反应制取。乙酰基丁酮与三硫化二磷反应,能生成2,5-二甲基噻吩。
应用
噻吩在许多场合可代替苯,用作制取染料和塑料的原料,但由于性质较为活泼,一般不如由苯制造出来的产品性质优良。噻吩也可用作溶剂。
参考资料
- Viktor Meyer. [On a substance that accompanies benzene in coal tar]. Berichte der Deutschen chemischen Gesellschaft. 1883, 16: 1465–1478 [2013-09-12]. doi:10.1002/cber.188301601324. (原始内容存档于2020-04-10).
- Ward C. Sumpter. . Chemical Reviews. 1944, 34 (3): 393–434. doi:10.1021/cr60109a003.
- 王积涛,张保申,王永梅,胡青眉编著。2003年。《有机化学(第二版)》。天津南开大学出版社 ISBN 9787310006205
- 谷亨杰 等. 有机化学(第二版). 高等教育出版社, 2000.7. pp 381. 吡咯、呋喃和噻吩的鉴定
- Jonathan Swanston "Thiophene" in Ullmann’s Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2006. doi:10.1002/14356007.a26_793.pub2.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.