多碘化物
制备
将单质碘溶解于碘化物溶液中,就能得到多碘化物的溶液,其中多数是 I3−(三碘阴离子):
室温下,I3− 和 I5− 在水溶液中的稳定常数为:
- ,
- ,
过量的碘与碘化钾长时间加热搅拌反应时,可以得到组成近似为 KI4 的多碘化物,其中的碘都是一样的,可以与 KI 中的碘发生同位素交换反应。
将比计量稍微过量的碘加入碘化四甲基铵的乙醇溶液中,加热搅拌使其溶解,然后缓慢冷却,可以析出深红色的三碘四甲基铵针状晶体 NMe4I3。如果用过量数倍的碘,则得到深绿色单斜晶系的五碘四甲基铵针状晶体 NMe4I5。将少量的上述晶体溶于大量水中,用有机溶剂如二氯甲烷萃取,然后用硫代硫酸钠滴定产生的碘(不断振荡溶液,终点无色),便可得知晶体中的多碘离子种类。(第41届IChO实验预备试题第1题)
性质
多碘离子的通式为 Imn−,一般m为奇数,n为1,形成诸如 I3−、I5−、I7− 之类的单阴离子。但是也有少数例外,例如 Cs2I8 中,就含有 I82− 离子。最简单的多碘离子是三碘离子(I3−)。目前合成的最复杂的多碘离子是 I164− 离子,存在于深蓝色针状晶体 R2H2I8 中(R+ 为质子化的可可碱),于1869年由S. M. Jorgensen首先制备出来。X射线衍射显示该离子为中心对称的平面结构,形状类似于“己”字,不过上下两横只有中间一横的一半长。[1]
多碘离子在非水溶剂中的稳定性要比在水中的稳定性高。例如25°C时,I3− 在水溶液中的生成稳定常数为710,而在丙酮中为108.3,在硝基乙烷中为106.7,在1,2-二氯乙烷中为107。对于相同阳离子的三卤化物,总体上讲,阴离子中心原子半径越大,形成的阴离子对称性越高,则该三卤离子稳定性也越高。然而,多卤化物在溶剂中的行为是复杂的,以乙腈、丙酮和硝基甲烷作溶剂时,三卤离子的稳定性为:,与在水中的恰好相反。
对于含有同一多碘离子的化合物,阳离子体积越大,该多碘化物也越稳定。一般常用的阳离子有:Cs+、NR4+(R=烷基,如NMe4+)和AsPh4+,它们与多碘离子可以形成稳定的化合物,有一定的晶形,可以从溶剂中析出。
结构
这些多碘离子都看作是由 I−、I2 和 I3− 单位形成的,其结构中,I-I-I 键角一般接近90°或180°,I-I 距离也一般都比碘分子中的 I-I 键长。根据成盐环境的不同,多碘离子的对称性会有不同,从而使同一离子的键长和键角产生差异,这是由于卤素原子本身性质不同,而且阳离子对多碘离子在空间上存在影响,使其产生程度不同的偏离。
一些多碘离子的结构如下:
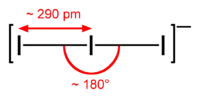
- I3− 离子:近似直线型结构。在晶体 [NEt4]I7 和 [AsPh4]+I3− 中,I3− 离子是直线型的;但在 CsI3、Cs2I8 和 NH4I3 中,I3− 离子却是不对称的。
- I5− 离子:一般为平面V型结构,可看成是两个 I2 向一个 I− 配位。[2]该离子中存在碘原子p轨道的相互作用。[3]
- I7− 离子:由中心对称的 I3− 离子和 I2 分子组成的三维骨架结构,其中每个 I3− 离子紧连4个 I2 分子,而每个 I2 分子紧连2个 I3− 离子,I3− 和 I2 之间有强烈的相互作用。
- I9− 离子:为扭曲的h型,非平面结构。
- I42− 离子:直线型([I-I-I-I]2− 或 [I…I-I…I]2−)。[4]两种模型中,I-I键总键长大致相等。
- I82− 离子:
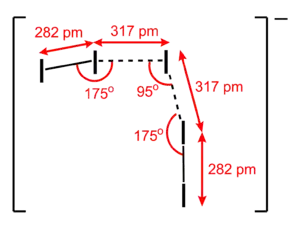 [Me4N]+I5− 中的 I5− 离子。 |
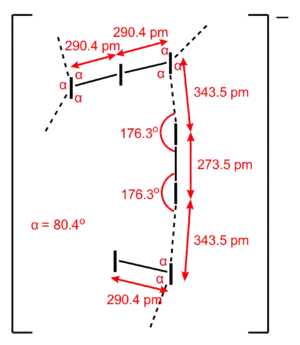 [Et4N]+I7− 中的 I7− 离子。 |
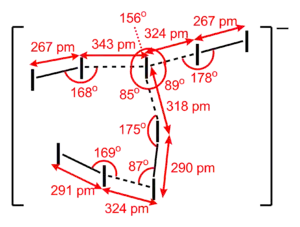 [Me4N]+I9− 中的 I9− 离子。 |
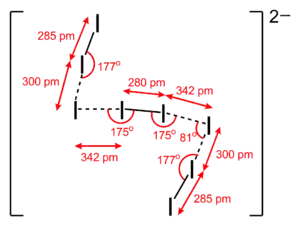 Cs2I8 中的 I82− 离子。 |
参考资料
- Herstein, F. H.; M. Kapon (1975). J. Chem. Soc., Chem. Commun., 677 (8).
- Atkins, P. W.; D. W. Shriver. 3rd Edn. OUP, Oxford, UK. 2001.
- Porterfield, W. W. . Addison Wesley, Reading, Massachusetts, USA. 1984: 223–224.
- Svensson, Per H.; Lars Kloo. . Chem. Rev. 2003, 103 (5): 1649–1684.
