氮芥类
虽然主要应用于临床,早期的氮芥类物质也能像芥子气一样用作化学武器。在第二次世界大战许多国家都有着氮芥的库存,但后来并未投入使用。他们与芥子气同属于毒性强烈且持久的糜烂性毒剂。因此,这些物质的生产和使用受到了严格的限制。氮芥类现已属于被淘汰的毒剂。
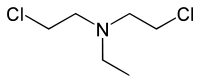 HN1(双(2-氯乙基)乙胺) |
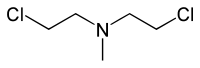 HN2(双(2-氯乙基)甲胺,氮芥) |
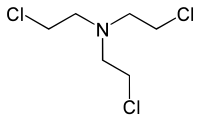 HN3(三(2-氯乙基)胺) |
氮芥类物质(英語:)是一类结构与芥子气相似的细胞毒化疗药物,属于非选择性烷化剂的一种。
氮芥类中毒性最强的是代号为“HN3”的三氯三乙胺。其盐酸盐为白色无嗅晶体,稳定性高于HN3本身,因此军方贮存或实验室制备的多为盐酸盐,使用时用NaOH处理并蒸馏即可得到纯净的HN3;此外因其极难水解,亦可用于食物与水源的染毒。
药物发现历史
早在二次世界大战时期的1942年12月,耶鲁大学已经开始了使用氮芥类物质治疗淋巴瘤的人体临床试验。[1] 但对氮芥化疗研究真正起到决定性影响的却是一场意外:1943年纳粹德国空襲巴里的时候,美国一艘被摧毁的船上秘密运载的芥子气泄露了出来,导致许多人中毒死亡;在尸检的时候医生发现他们均表现出不同程度的淋巴和骨髓抑制,白细胞都显著减少。[2] 二战结束之后,科学家发现耶鲁大学的研究和意大利巴里的事故所涉及的是类似的化学物质,并为此开始了一系列的研究。
在1946年,美国药理学家路易斯·戈德曼(Louis S. Goodman)和阿尔弗雷德·吉尔曼(Alfred Gilman)使用使用芥子气成功缓解了他们在小鼠身上引入的淋巴瘤。之后他们又在一位患有非霍奇金氏淋巴瘤的病人身上注射了代号为“HN2”的军用毒剂——他们观察到肿瘤有着显著的缩小。这成功证明了药物可以治疗癌症;这种物质,作为人类历史上发现的第一种化疗药物,被命名为氮芥(mustine)。[3]
例子
最早的氮芥类药物盐酸氮芥已不再是常用化疗药物。其他的氮芥类化疗药物包括早期的环磷酰胺(十分常用)、苯丁酸氮芥(十分常用)、美法仑(常用)、苯达莫司汀(少用),以及较新的异环磷酰胺(常用)和雌莫司汀(少用)。[4]
能用作化学武器的三种氮芥类化合物被禁止化学武器公约列为了第1类物质,被严格地管制着。它们的代号是:
- HN1:双(2-氯乙基)乙胺
- HN2:双(2-氯乙基)甲胺(氮芥)
- HN3:三(2-氯乙基)胺
作用机理
氮介類藥物作用機理如下[5]:
- 第一種路徑:DNA中的親核性官能基與氮介類藥物反應,生成複合物,如下圖
 氮芥類藥物第一條作用路徑
氮芥類藥物第一條作用路徑 - 第二種路徑:氮芥类物质(NMs)能够通过分子内缩合(脱去Cl)形成吖丙啶离子。吖丙啶集团随即作为亲电试剂被鸟嘌呤的亲核中心7号位氮原子进攻,发生双分子亲核取代反应,导致鸟嘌呤的烷基化。
- 2-1 路徑:然后,另一端发生同样的反应,在DNA双链间形成交联。[6][7] 一般来说,它们形成的是在DNA链上GNC段5'端的1,3交联。[8][9][10]
 氮芥类化合物发生SN2反应的机理
氮芥类化合物发生SN2反应的机理 - 2-2路徑:另一端發生同樣的反應,但是是與蛋白質中的親核性官能基反應
- 2-3路徑:與單一鳥嘌呤形成的複合物,互變成另一構形,此構形,會與胸腺嘧啶做鹼基互對,導致 DNA 序列錯誤
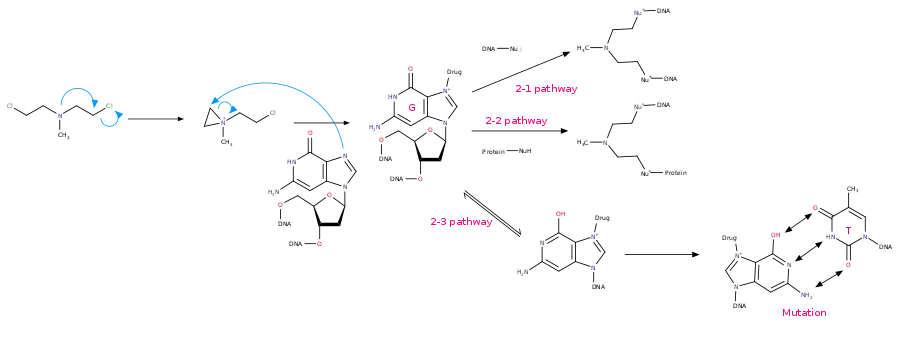 氮芥類藥物第2-1,2-2,2-3條作用路徑
氮芥類藥物第2-1,2-2,2-3條作用路徑 - 2-4路徑:與單一鳥嘌呤形成的複合物,與水反應,使得嘌呤水解,導致 DNA 鏈斷裂,如下圖
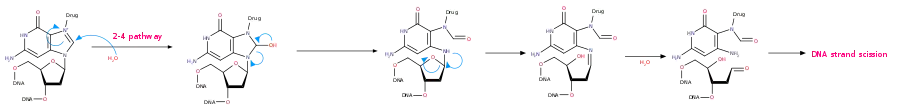 氮芥類藥物第2-4條作用路徑
氮芥類藥物第2-4條作用路徑 - 2-5路徑:與單一鳥嘌呤形成的複合物,分子內反應使嘌呤脫去,接著再分子內反應,使五碳糖開環,然後脫磷酸,導致 DNA 鏈斷裂,如下圖
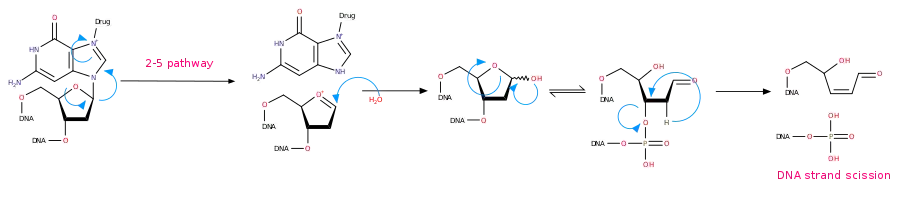 氮芥類藥物第2-5條作用路徑
氮芥類藥物第2-5條作用路徑
- 2-1 路徑:然后,另一端发生同样的反应,在DNA双链间形成交联。[6][7] 一般来说,它们形成的是在DNA链上GNC段5'端的1,3交联。[8][9][10]
这种对DNA的损伤能够阻碍DNA复制和转录或引起基因突变,因此具有强烈的细胞毒性与致癌性。这种强烈的细胞毒性使得氮芥类物质成为了一类十分有效的化疗药物,然而同时也使得它们有着毒性过大、副作用过多的缺点。
参考资料
- Gilman A. . Am. J. Surg. May 1963, 105 (5): 574–8. PMID 13947966. doi:10.1016/0002-9610(63)90232-0.
- Hirsch J. . JAMA. September 2006, 296 (12): 1518–20. PMID 17003400. doi:10.1001/jama.296.12.1518.
- Goodman LS, Wintrobe MM, Dameshek W, Goodman MJ, Gilman A, McLennan MT. . JAMA. May 1984, 251 (17): 2255–61. PMID 6368885. doi:10.1001/jama.251.17.2255.
- Mattes, W. B.; Hartley, J. A.; Kohn, K. W. . Nucleic Acids Research. 1986, 14 (7): 2971–2987. PMC 339715. PMID 3960738. doi:10.1093/nar/14.7.2971.
- Carmen Avendano, J. Carlos Menendez. . Elsevier Science. 2015.
- Geiduschek EP. . Proc. Natl. Acad. Sci. U.S.A. July 1961, 47 (7): 950–5. PMC 221307. PMID 13704192. doi:10.1073/pnas.47.7.950.
- Brookes P, Lawley PD. . Biochem. J. September 1961, 80 (3): 496–503. PMC 1243259. PMID 16748923.
- Rink SM, Solomon MS, Taylor MJ, Rajur SB, McLaughlin LW, Hopkins PB. . Journal of the American Chemical Society. 1993, 115 (7): 2551–7. doi:10.1021/ja00060a001.
- Dong Q, Barsky D, Colvin ME; 等. . Proc. Natl. Acad. Sci. U.S.A. December 1995, 92 (26): 12170–4. PMC 40318. PMID 8618865. doi:10.1073/pnas.92.26.12170.
- Bauer GB, Povirk LF. . Nucleic Acids Res. March 1997, 25 (6): 1211–8. PMC 146567. PMID 9092631. doi:10.1093/nar/25.6.1211.
- Guainazzi, A.; Schärer, O. D. . Cellular and Molecular Life Sciences. 2010, 67 (21): 3683–3697. PMID 20730555. doi:10.1007/s00018-010-0492-6.
| 查询維基詞典中的。 |
