王水
王水,又称王酸、硝基盐酸,由浓硝酸和浓盐酸按1:3(体积比)混合而成,酸性和氧化性极强,是少数能够溶解金和铂的溶液,也因此得名。王水不稳定,極易变质分解,暴露在空气中会冒黄色烟雾,不宜长期存放,一般在使用前配制,现配现用。[1] 王水在冶金工业和化学分析用于溶解金属,也用于蚀刻工艺。
| 王水[lower-alpha 1] | |
|---|---|
 | |
 | |
| IUPAC名 nitric acid hydrochloride | |
| 别名 | 王水、王酸、硝基盐酸、aqua regia、nitrohydrochloric acid |
| 识别 | |
| CAS号 | 8007-56-5 |
| PubChem | 62687 |
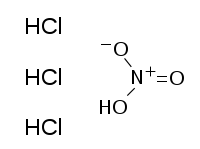
| SMILES |
|
| 性质 | |
| 化学式 | HNO3+3 HCl |
| 外观 | 红色、黄色或金色的冒烟液体 |
| 密度 | 1.01–1.21 g/cm3 |
| 熔点 | −42 °C |
| 沸点 | 108 °C |
| 溶解性(水) | 混合于水 |
| 蒸氣壓 | 21 mbar |
| 危险性 | |
| NFPA 704 |
 0
3
0
OX
|
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
王水一般用在蚀刻工艺和一些检测分析过程中。不过,一些金属元素如鉭(Ta)、銠、釕、鋨、銥、鈦、無機鹽類如氯化银、硫酸钡,有機物聚四氟乙烯、蠟,無機化合物矽(Si)、玻璃,不受王水腐蚀。
历史
盐酸是于约800年左右波斯炼金术士贾比尔·伊本·哈杨(Jabir ibn Hayyan)将食盐与矾(硫酸)混合到一起时发现的。他将盐酸与硝酸混合在一起发明了能够溶解金的王水。
二次大战德国侵略丹麦期间,匈牙利的化学家乔治·德海韦西将德国物理学家马克斯·冯·劳厄(1914)和詹姆斯·弗兰克(1925)所获得的金质诺贝尔奖章溶化在王水中,使纳粹德国无法抢走奖章。德海韦西将融化了奖章的王水放置在他位于尼尔斯·玻尔研究所的实验室的架子上。溶液瓶子和其他数百个瓶子混在一起,并未被纳粹注意到。战后,德海韦西将完全没有受到挪动的溶液回收并析出了其中的黄金,并将黄金交还给了诺贝尔基金会和瑞典皇家科学院。后者重铸了奖章,并将它们交还给了劳厄和弗兰克。
原理
王水中的硝酸有强氧化性,氯离子有强配位能力。金或铂可以被硝酸氧化为金属离子,但在仅有硝酸的情况下,这些金属离子会阻碍氧化反应继续进行。而王水中高浓度的氯离子会与金属离子形成配合物,降低溶液中金属离子的浓度,使氧化反应得以继续。以金为例,[2]
Au与Cl−配位形成AuCl4−,增强金的还原能力,使黄金可以完全溶解。
由於王水與塊狀銀反應在銀表面產生氯化銀(AgCl)白色沉澱(氯化銀既不溶於水,也不溶於硝酸)覆蓋住銀,而阻礙進一步反應,所以塊狀銀幾乎不溶於王水。另外一些惰性的金属如钽、銠、釕、锇、銥、鈦因为其离子不能和氯离子生产稳定的配合物,所以不受王水腐蚀。
犯罪
注释
- 数据仅在硝酸与盐酸以1:3莫耳數比混合的情况下准确。
参考文献
- 魏明通. . 北京: 慧邦科技有限公司. 2006: 227. ISBN 9571143499.
- J. A. 迪安. . 北京: 科学出版社. 2003. ISBN 7-03-010409-9.
- . 國立清華大學簡訊. 1998年8月10日, (第346期) [2014-05-28]. (原始内容存档于2012-12-04).
