锇
鋨(Osmium,舊譯作銤[2]、鐭)是一種化學元素,符號為Os,原子序為76。鋨金屬堅硬、易碎,呈藍白色。鋨屬於鉑系過渡金屬,是自然界中密度最高的元素,密度有22.59 g/cm3。鋨一般以痕量存在於自然中,大部份在鉑礦藏的合金當中。鋨與鉑、銥及其他鉑系元素形成的合金具有超強的耐用性和硬度,能用於製造鋼筆筆頭和電觸頭等。[3]
| 外觀 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
銀色,藍色光澤 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概況 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 | 鋨(Osmium)·Os·76 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素類別 | 过渡金属 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·週期·區 | 8 ·6·d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 標準原子質量 | 190.23 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子排布 | [Xe] 4f14 5d6 6s2 2, 8, 18, 32, 14, 2  鋨的电子層(2, 8, 18, 32, 14, 2) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 歷史 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 發現 | 史密森·特南特(1803年) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分離 | 史密森·特南特(1803年) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性質 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物態 | 固體 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 22.59 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點時液體密度 | 20 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點 | 3306 K,3033 °C,5491 °F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸點 | 5285 K,5012 °C,9054 °F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化熱 | 57.85 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化熱 | 738 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比熱容 | 24.7 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸氣壓
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性質 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化態 | 8, 7, 6, 5, 4, 3, 2, 1, 0, -1, -2 (微酸性氧化物) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電負性 | 2.2(鲍林标度) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電離能 | 第一:840 kJ·mol−1 第二:1600 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半徑 | 135 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共價半徑 | 144±4 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 雜項 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶體結構 | 六方密堆積 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 順磁性[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電阻率 | (0 °C)81.2 n Ω·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱導率 | 87.6 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 膨脹係數 | (25 °C)5.1 µm·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 聲速(細棒) | (20 °C)4940 m·s−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 222 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 體積模量 | 462 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.25 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 7.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 3920 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS號 | 7440-04-2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最穩定同位素 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:鋨的同位素
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
性質
物理性质

鋨呈灰藍色,其密度比銥稍高,是密度最高的穩定元素。[4]從X射線散射數據計算出的密度數值最準確。這種方法得出銥的密度為22.562 ± 0.009 g/cm3,而鋨的密度為22.587 ± 0.009 g/cm3。[5]
鋨金屬堅硬,在高溫下可保持光澤。鋨的壓縮性非常低,因此體積模量非常高,在395和462 GPa之間,與鑽石的443 GPa相約。在壓力為4 GPa的情況下,鋨的硬度也比較高。[6][7][8]由於堅硬易碎,蒸氣壓低(鉑系元素中最低),熔點極高(所有元素中第四高),所以固體鋨很難塑形,生產過程十分困難。
化學性质
| 鋨的氧化態 | |
|---|---|
| −2 | Na 2[Os(CO) 4] |
| −1 | Na 2[Os 4(CO) 13] |
| 0 | Os 3(CO) 12 |
| +1 | OsI |
| +2 | OsI 2 |
| +3 | OsBr 3 |
| +4 | OsO 2、OsCl 4 |
| +5 | OsF 5 |
| +6 | OsF 6 |
| +7 | OsOF 5 |
| +8 | OsO 4, Os(NCH3) 4 |
鋨可以形成氧化態為−2至+8的化合物。最常見的氧化態有+2、+3、+4和+8。+8態是任何元素可達至的最高氧化態,除鋨以外擁有+8態的只有氙、[9][10]釕、[11]𨭆、[12]銥、[13]鈈[14]和鋦(尚未確定)。[15]氧化態為−1和−2的Na
2[Os
4(CO)
13]和Na
2[Os(CO)
4]反應性很強,可用於合成鋨的原子簇化合物。[16][17]
最常見的+8態化合物是鋨粉末在空氣中形成的四氧化鋨。四氧化鋨是一種淺黃色晶體,揮發性高,可溶於水,味道很強,具有毒性。鋨粉末的味道與四氧化鋨一樣。[18]四氧化鋨與鹼反應會形成紅色的鋨酸OsO
4(OH)2−
2,與氨則形成次氮基鋨酸OsO
3N−
。[19][20][21]四氧化鋨在130 °C氣化,是一種強氧化劑。相比之下,二氧化鋨(OsO2)則是黑色的不揮發物質,反應性和毒性也遠低於四氧化鋨。
具有主要用途的鋨化合物只有兩種:四氧化鋨在電子顯微鏡照相中用以對組織染色,並在有機合成過程中作烯烴的氧化劑;不揮發的鋨酸鹽則用在有機氧化反應當中。[22]
鋨可以形成各種鹵化物,包括五氟化鋨(OsF5)、三氯化鋨(OsCl3)、三溴化鋨(OsBr3)、三碘化鋨(OsI3)等等。鋨的氧化態較低時,大直徑的鹵素可以使兩者的化合物更加穩定,所以以上的三鹵化物存在,但三氟化鋨(OsF3)尚未被發現。唯一一種氧化態為+1的鋨化合物是碘化鋨(OsI)。鋨在一些羰基配合物中的氧化態為0,例如十二羰基三鋨(Os
3(CO)
12)。[19][20][23][24]
鋨在氧化態較低時,強σ供體(如胺)和π受體(含氮的雜環化合物)都可以增加其穩定性;氧化態較高時,強σ和π供體都可增強穩定性,如O2−
和N3−
。[25]
雖然鋨能以多種氧化態形成化合物,但是純金屬鋨在標準溫度和壓力下可抗禦所有酸和鹼的侵蝕,甚至包括王水。
同位素
鋨共有7種自然產生的同位素,其中6種為穩定同位素:184
Os、187
Os、188
Os、189
Os、190
Os和(比例最高的)192
Os。186
Os會進行α衰變,但由於半衰期長達(2.0 ± 1.1)×1015年,所以一般可當做穩定同位素。所有穩定同位素都預測可以進行α衰變,但由於半衰期很長,因而只有186
Os的衰變得到了實驗證實。理論預測,184
Os和192
Os可進行雙β衰變,但這尚無實驗證據。[26]
187
Os是187
Re的衰變產物(半衰期為4.56×1010年),被廣泛用於測定地球岩石以及隕石的年齡(見錸鋨定年法)。此同位素還可以用於測量大陸風化的強度,及推斷大陸穩定地塊根部的地幔在何時穩定下來。含錸礦石中含有異常高的187
Os,也是因為這一衰變。[27]然而最為常用的鋨定年法則是銥鋨定年法。這種方法可分析K-T界線上的衝擊石英,也就是6600萬年前恐龍滅絕時所留下的地質特徵。[28]
歷史
1803年,史密森·特南特和威廉·海德·沃拉斯頓在英國倫敦發現了鋨元素。[29]鋨的發現與鉑以及其他鉑系元素息息相關。17世紀,人們在哥倫比亞喬科省的銀礦中發現了鉑。[30]化學家後來發現這種金屬不是合金,而是一種新元素,並在1748年發表了這一發現。[31]他們將鉑溶於王水(鹽酸和硝酸的混合物),以產生穩定的鹽。每一次實驗都有留有少量黑色的不可溶殘留物。[32]約瑟夫·普魯斯特以為殘留物是石墨。[32]維多·科萊-德科提爾(Victor Collet-Descotils)、福爾克拉伯爵安東萬·弗朗索瓦(Antoine François, comte de Fourcroy)和路易-尼古拉·沃克蘭在1803年同樣觀測到這一殘留物,但因未能取得足夠的物質而無法進行更多的實驗。[32]
1803年,史密森·特南特分析了這些殘留物,並推斷其中必含新的金屬元素。沃克朗把該粉末來回在酸鹼中浸洗,[33]取得了一種揮發性氧化物。他認為這是新元素的氧化物,並把新元素命名為「ptene」,源於希臘文的「」(ptènos),即「有翼的」。[34][35]特南特則擁有更大量的殘留物,並在不久後辨認出兩種新元素,也就是鋨和銥。[32][33]他再對產物加入氫氧化鈉,在加熱後製成了一種黃色溶液(很可能是順[Os(OH)2O4]2−)。溶液經過酸化後,他用蒸餾法取得了OsO4。[34]由於製成的四氧化鋨具有強烈的焦味,所以他把這一新元素命名為現名「osmium」,源於希臘文「οσμή」(osme),即「臭味」。[36]鋨元素的發現被記錄在1804年6月21日致皇家學院的一封信中。[32][37]
鈾和鋨在形成氨的哈柏法中是有效的催化劑,這使該方法可以得到廣泛應用。當時在BASF一個以卡爾·博施為首的團隊購入了世界上大部份的鋨來作催化劑。1908年,同一個團隊發現了使用鐵和氧化鐵的更為便宜的催化劑,因此無須再使用昂貴稀少的鋨元素。[38]
存量

鋨是地球地殼中最稀有的穩定元素,在大陸地殼裡的平均質量比例只有1千億分之5。[40]
鋨在自然中以純金屬或合金的形態出現,尤其是各種比例的銥﹣鋨合金。[33]鎳和銅礦藏中還含有鋨和銥的硫化物、碲化物、銻化物和砷化物。與其他鉑系元素一樣,鋨可以形成自然鎳合金及銅合金。[41]
地殼中有三種地質結構的鋨含量最高:火成岩、撞擊坑以及前二者演化而成的地質結構。最大的已知礦藏有南非的布什維爾德火成雜岩體、[42]俄羅斯的諾里爾斯克及加拿大的索德柏立盆地等。美國有較小的鋨礦藏。[42]前哥倫布時期哥倫比亞喬科省居民所用的沖積層礦藏至今仍是鉑系元素的一大來源。第二大的沖積層礦藏位於俄羅斯烏拉爾山脈。[39][43]
生產

鋨是鎳和銅開採和提煉過程的副產品。在鎳和銅的電解精煉過程中,金、銀等貴金屬、鉑系元素以及硒和碲等非金屬元素都會積聚在正電極上。[44][45]這一泥狀物質要進入溶液才可把其中的金屬分離出來。具體方法取決於混合物的成份,但主要有兩種:加入過氧化鈉後溶於王水,或直接溶於氯和氫氯酸的混合溶液。[42][46]鋨、釕、銠和銥不可溶於王水,可從鉑、金等金屬分離開來。銠與熔化的硫酸氫鈉反應後會再分離出來。剩餘的物質中含有釕、鋨和銥,其中銥不可溶於氧化鈉。加入氧化鈉會產生水溶的釕鹽和鋨鹽,而在氧化後,這些鹽會變成揮發性的RuO
4和OsO
4。氯化銨可將前者沉澱為(NH4)3RuCl6。
溶解後的鋨要從其他鉑系元素中分離出來。分離方法包括蒸餾法和用適當的有機溶劑把四氧化鋨提取出來。[47]特南特和沃拉斯頓所用的方法類似於前者。兩種方法所得出的產物與氫進行還原反應,產生粉狀或海綿狀鋨粉末,再經粉末冶金手法進行加工。[48]
鋨生產商和美國地質調查局都沒有公佈鋨的產量數據。1971年發佈的數字當中,[49]單在美國的消耗量共有2000金衡盎司(62公斤),意味著產量低於每年1噸。2012年美國鋨產量的估值為75公斤。[50]
鋨一般以99%或更高纯度的粉末的形式出售。鋨的量度單位可以採用金衡制或公制。2012年鋨的價格約為每金衡盎司400美元(每克13美元)。[51][52]
應用
由於鋨的氧化物具有高揮發性和高毒性,而鋨金屬容易形成氧化物,所以其金屬態的應用很少。人們一般使用的是耐用性很強的鋨合金。銥鋨合金非常堅硬,可同其他鉑系金屬用於製造需耐用的鋼筆筆頭、機器樞軸及電觸頭等。1945年至1955年左右的留聲機唱針頭也含有銥鋨合金。雖然鋨合金比鋼和鉻耐用,但是卻遠比藍寶石和鑽石遜色,因此最終被淘汰了。[53]
四氧化鋨可用於指紋識別,[54]以及在光學和電子顯微鏡照相中對脂組織進行染色。四氧化鋨的氧化性很強,所以能與未飽和碳﹣碳鍵反應,從而連接油脂。因此在染色的同時,它還會固定生物膜。鋨原子的電子密度極高,在透射電子顯微鏡(TEM)下能大大提高對比度。未經處理的碳物質在TEM下的對比度很低(見圖)。[22]鐵氰化鋨(OsFeCN)也有染色兼固定的性質。[55]
四氧化鋨和鋨酸鉀是化學合成過程中重要的氧化劑,但都是劇毒。夏普萊斯不對稱雙羥基化反應中,鋨酸將雙鍵轉換為鄰二醇。巴里·夏普萊斯因這一發現而在2001年獲得諾貝爾化學獎。[56][57]OsO4非常昂貴,所以化學家一般改用KMnO4。雖然產量會降低,但後者的價格遠沒有鋨高。[58]
1898年,奧地利化學家卡爾·奧爾·馮·威爾斯巴赫(Auer von Welsbach)發明了用鋨作為燈絲的電燈,並在1902年推出市場。不過,鎢的熔點是所有金屬中最高的,用於電燈時還能增加光效和延長燈泡壽命,所以在幾年後就把鋨淘汰了。[34]
和鈀相似,鋨粉末可有效吸收氫原子,因此有潛力作金屬氫化物電池電極。不過鋨價格高昂,而且會與氫氧化鉀(最常用的電池電解質)反應。[59]
鋨的紫外線反射率很高:鋨對600 Å波長的反射率是金的兩倍。[60]鋨因此被用於大小有限的太空紫外光譜儀。多個太空穿梭機任務曾搭載鍍鋨鏡子進入太空,但不久後人們發現近地軌道中的氧自由基足以破壞鋨塗層。[61]
斯堪的納維亞的某些醫院在對關節炎病人進行滑膜切除術時,[62]需病人服食四氧化鋨(OsO4)。雖然四氧化鋨有毒,但並沒有病人長期副作用的報告,因此某些鋨化合物可能可以和生物體相容。2011年,科學家宣稱鋨(VI)[63]和鋨(II)[64]化合物在活體內有抗癌的作用,且有潛力作抗癌藥物。[65]
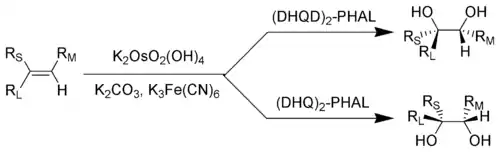 夏普萊斯不對稱雙羥基化反應:RL=大取代基,RM=中取代基,RS=小取代基
夏普萊斯不對稱雙羥基化反應:RL=大取代基,RM=中取代基,RS=小取代基
安全
鋨金屬粉末可自燃。[49]鋨在室溫下會和空氣中的氧反應,形成揮發性四氧化鋨。某些鋨化合物在有氧環境下也會轉變成四氧化鋨。[49]
四氧化鋨的揮發性很高,能輕易穿透皮膚,且經吸入、進食和皮膚接觸後都是毒物。[68]如果空氣中含有低濃度四氧化鋨,會造成肺淤血及皮膚和眼部損害,因此四氧化鋨必須在通風櫃內處理。[18]粟米油等含多元不飽和脂肪的植物油可迅速將四氧化鋨還原成相對惰性的化合物。[69]
參考資料
- Magnetic susceptibility of the elements and inorganic compounds 的存檔,存档日期2011-03-03., in Handbook of Chemistry and Physics 81st edition, CRC press.
- “銤”亦為化學元素鋂的舊譯,因造成混淆而採用新譯
- Hammond "Osmium", C. R., p. 4–25 in Lide, D. R. (编), 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- Arblaster, J. W. (PDF). Platinum Metals Review. 1989, 33 (1): 14–16 [2013-12-25]. (原始内容 (PDF)存档于2012-02-07).
- Arblaster, J. W. . Platinum Metals Review. 1995, 39 (4): 164 [2013-12-25]. (原始内容存档于2011-09-27).
- Weinberger, Michelle; Tolbert, Sarah; Kavner, Abby. . Phys. Rev. Lett. 2008, 100 (4): 045506. Bibcode:2008PhRvL.100d5506W. PMID 18352299. doi:10.1103/PhysRevLett.100.045506.
- Cynn, Hyunchae; Klepeis, J. E.; Yeo, C. S.; Young, D. A. . Physical Review Letters. 2002, 88 (13): 135701. Bibcode:2002PhRvL..88m5701C. PMID 11955108. doi:10.1103/PhysRevLett.88.135701.
- Sahu, B. R.; Kleinman, L. . Physical Review B. 2005, 72 (11): 113106. Bibcode:2005PhRvB..72k3106S. doi:10.1103/PhysRevB.72.113106.
- Selig, H.; Claassen, H. H.; Chernick, C. L.; Malm, J. G.; Huston, J. L. . Science. 1964, 143 (3612): 1322–3. Bibcode:1964Sci...143.1322S. JSTOR 1713238. PMID 17799234. doi:10.1126/science.143.3612.1322.
- Huston, J. L.; Studier, M. H.; Sloth, E. N. . Science. 1964, 143 (3611): 1162–3. Bibcode:1964Sci...143.1161H. JSTOR 1712675. PMID 17833897. doi:10.1126/science.143.3611.1161-a.
- Barnard, C. F. J. . Platinum Metals Review. 2004, 48 (4): 157. doi:10.1595/147106704X10801.
- (PDF). Gesellschaft für Schwerionenforschung mbH. 2002 [2007-01-31]. (原始内容存档 (PDF)于2012-01-14).
- Gong, Yu; Zhou, Mingfei; Kaupp, Martin; Riedel, Sebastian. . Angewandte Chemie International Edition. 2009, 48 (42): 7879. doi:10.1002/anie.200902733.
- Domanov, V. P.; Lobanov, Yu. V. . Radiochemistry (SP MAIK Nauka/Interperiodica). February 2009, 51 (1): 14–17. doi:10.1134/S1066362209010044.
- Domanov, V. P. . Radiochemistry (SP MAIK Nauka/Interperiodica). January 2013, 55 (1): 46–51. doi:10.1134/S1066362213010098.
- Krause, J.; Siriwardane, Upali; Salupo, Terese A.; Wermer, Joseph R.; Knoeppel, David W.; Shore, Sheldon G. . Journal of Organometallic Chemistry. 1993, 454: 263–271. doi:10.1016/0022-328X(93)83250-Y.
- Carter, Willie J.; Kelland, John W.; Okrasinski, Stanley J.; Warner, Keith E.; Norton, Jack R. . Inorganic Chemistry. 1982, 21 (11): 3955–3960. doi:10.1021/ic00141a019.
- Mager Stellman, J. . . International Labour Organization. 1998: 63.34. ISBN 978-92-2-109816-4. OCLC 35279504 45066560.
- Holleman, A. F.; Wiberg, E.; Wiberg, N. . Academic Press. 2001. ISBN 0-12-352651-5. OCLC 47901436.
- Griffith, W. P. . Quarterly Review of the Chemical Society. 1965, 19 (3): 254–273. doi:10.1039/QR9651900254.
- Subcommittee on Platinum-Group Metals, Committee on Medical and Biologic Effects of Environmental Pollutants, Division of Medical Sciences, Assembly of Life Sciences, National Research Council. . National Academy of Sciences. 1977: 55. ISBN 0-309-02640-7.
- Bozzola, John J.; Russell, Lonnie D. . . Sudbury, Mass.: Jones and Bartlett. 1999: 21–31. ISBN 978-0-7637-0192-5.
- Greenwood, N. N.; Earnshaw, A. 2nd. Oxford:Butterworth-Heinemann. 1997: 1113–1143, 1294. ISBN 0-7506-3365-4. OCLC 213025882 37499934 41901113.
- Gulliver, D. J; Levason, W. . Coordination Chemistry Reviews. 1982, 46: 1–127. doi:10.1016/0010-8545(82)85001-7.
- Peter A. Lay; W. Dean Harman. . A. G. Sykes. Academic Press. 1992: 221. ISBN 0-12-023637-0.
- Audi, G.; Bersillon, O.; Blachot, J.; Wapstra, A.H. . Nuclear Physics A (Atomic Mass Data Center). 2003, 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- Dąbek, Józef; Halas, Stanislaw. . Geochronometria. 2007, 27: 23–26. doi:10.2478/v10003-007-0011-4.
- Alvarez, L. W.; Alvarez, W.; Asaro, F.; Michel, H. V. . Science. 1980, 208 (4448): 1095–1108. Bibcode:1980Sci...208.1095A. PMID 17783054. doi:10.1126/science.208.4448.1095.
- Venetskii, S. I. . Metallurgist. 1974, 18 (2): 155–157. doi:10.1007/BF01132596.
- McDonald, M. . Platinum Metals Review. 959, 3 (4): 140–145 [2013-12-25]. (原始内容存档于2011-06-09).
- Juan, J.; de Ulloa, A. 1. 1748: 606 (西班牙语).
- Hunt, L. B. (PDF). Platinum Metals Review. 1987, 31 (1): 32–41 [2012-03-15]. (原始内容存档 (PDF)于2012-03-04).
- Emsley, J. . . Oxford, England, UK: Oxford University Press. 2003: 199–201. ISBN 0-19-850340-7.
- Griffith, W. P. . Platinum Metals Review. 2004, 48 (4): 182–189. doi:10.1595/147106704X4844.
- Thomson, T. . Baldwin & Cradock, London; and William Blackwood, Edinburgh. 1831: 693.
- Weeks, M. E. 7. Journal of Chemical Education. 1968: 414–418. ISBN 0-8486-8579-2. OCLC 23991202.
- Tennant, S. . Philosophical Transactions of the Royal Society. 1804, 94: 411–418. JSTOR 107152. doi:10.1098/rstl.1804.0018.
- Smil, Vaclav. . MIT Press. 2004: 80–86. ISBN 978-0-262-69313-4.
- George, Micheal W. (PDF). United States Geological Survey USGS. [2008-09-16]. (原始内容存档 (PDF)于2019-01-11).
- Wedepohl, Hans K. . Geochimica et Cosmochimica Acta. 1995, 59 (7): 1217–1232. Bibcode:1995GeCoA..59.1217W. doi:10.1016/0016-7037(95)00038-2.
- Xiao, Z.; Laplante, A. R. . Minerals Engineering. 2004, 17 (9–10): 961–979. doi:10.1016/j.mineng.2004.04.001.
- Seymour, R. J.; O'Farrelly, J. I. . . Wiley. 2001. doi:10.1002/0471238961.1612012019052513.a01.pub2.
- (PDF). United States Geological Survey USGS. [2008-09-16]. (原始内容存档 (PDF)于2019-01-11).
- George, M. W. (PDF). U.S. Geological Survey Mineral Commodity Summaries (USGS Mineral Resources Program). 2008 [2013-12-25]. (原始内容存档 (PDF)于2019-01-11).
- George, M. W. (PDF). United States Geological Survey USGS. [2008-09-16]. (原始内容存档 (PDF)于2019-01-11).
- Renner, H.; Schlamp, G.; Kleinwächter, I.; Drost, E.; Lüschow, H. M.; Tews, P.; Panster, P.; Diehl, M.; Lang, J.; Kreuzer, T.; Knödler, A.; Starz, K. A.; Dermann, K.; Rothaut, J.; Drieselman, R. . . Wiley. 2002. doi:10.1002/14356007.a21_075.
- Gilchrist, Raleigh. . Chemical Reviews. 1943, 32 (3): 277–372. doi:10.1021/cr60103a002.
- Hunt, L. B.; Lever, F. M. (PDF). Platinum Metals Review. 1969, 13 (4): 126–138 [2008-10-02]. (原始内容 (PDF)存档于2008-10-29).
- Smith, Ivan C.; Carson, Bonnie L.; Ferguson, Thomas L. . Environmental Health Perspectives. 1974, 8: 201–213. JSTOR 3428200. PMC 1474945. PMID 4470919. doi:10.2307/3428200.
- (PDF). USGS. [27 May 2013]. (原始内容存档 (PDF)于2017-05-13).
- Osmium 页面存档备份,存于. Los Alamos National Laboratory's Chemistry Division
- Live Osmium prices 页面存档备份,存于. TaxFreeGold.com. Accessed 6 April 2010
- Stephen D. Cramer and Bernard S. Covino, Jr.; Bernard S. Covino, Jr. . ASM International. 2005. ISBN 978-0-87170-707-9.
- MacDonell, Herbert L. . The Journal of Criminal Law, Criminology, and Police Science. 1960, 51 (4): 465–470. JSTOR 1140672. doi:10.2307/1140672.
- Chadwick, D. . John Wiley and Sons. 2002: 259–264. ISBN 0-470-84479-5.
- Kolb, H. C.; Van Nieuwenhze, M. S.; Sharpless, K. B. . Chemical Reviews. 1994, 94 (8): 2483–2547. doi:10.1021/cr00032a009.
- Colacot, T. J. (PDF). Platinum Metals Review. 2002, 46 (2): 82–83 [2013-12-25]. (原始内容 (PDF)存档于2013-01-31).
- Osmium tetroxide as a reagent in organic chemistry — Master Organic Chemistry 页面存档备份,存于. Masterorganicchemistry.com. Retrieved on 2012-12-07.
- Antonov, V. E.; Belash, I. T.; Malyshev, V. Yu.; Ponyatovsky, E. G. (PDF). Platinum Metals Revie. 1984, 28 (4): 158–163 [2013-12-25]. (原始内容 (PDF)存档于2013-01-31).
- Torr, Marsha R. . Applied Optics. 1985, 24 (18): 2959. Bibcode:1985ApOpt..24.2959T. PMID 18223987. doi:10.1364/AO.24.002959.
- Gull, T. R.; Herzig, H; Osantowski, JF; Toft, AR. . Applied Optics. 1985, 24 (16): 2660. Bibcode:1985ApOpt..24.2660G. PMID 18223936. doi:10.1364/AO.24.002660.
- Sheppeard, H.; D. J. Ward. . Rheumatology. 1980, 19 (1): 25–29. PMID 7361025. doi:10.1093/rheumatology/19.1.25.
- Lau, T.-C; W.-X. Ni, W.-L. Man, M. T.-W. Cheung, R. W.-Y. Sun, Y.-L. Shu, Y.-W. Lam, C.-M. Che. . Chem. Commun. 2011, 47 (7): 2140–2142. doi:10.1039/C0CC04515B.
- Sadler, Peter; Steve D. Shnyder, Ying Fu, Abraha Habtemariam, Sabine H. van Rijt, Patricia A. Cooper, Paul M. Loadman. . Med. Chem. Commun. 2011, 2 (7): 666–668. doi:10.1039/C1MD00075F.
- Fu, Ying; Romero, María J.; Habtemariam, Abraha; 等. . Chemical Science. 2012, 3 (8): 2485–2494. doi:10.1039/C2SC20220D.
- (PDF). NASA. [2009-06-06]. (原始内容存档 (PDF)于2010-05-22).
- Linton, Roger C.; Kamenetzky, Rachel R.; Reynolds, John M.; Burris, Charles L. . In NASA. Langley Research Center (NASA). 1992: 763. Bibcode:1992ldef.symp..763L.
- Luttrell, William E.; Giles, Cory B. . Journal of Chemical Health and Safety. 2007, 14 (5): 40–41. doi:10.1016/j.jchas.2007.07.003.
- . University of California, San Diego. [2009-06-02]. (原始内容存档于2006-02-21).
外部連結
- 元素锇在洛斯阿拉莫斯国家实验室的介紹(英文)
- —— {{LinkForElement|Osmium| }}(英文)
- 元素锇在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素锇在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – {{LinkForElement|Osmium| }}(英文)
