胺
胺类(英語:amine)是氨分子(NH3)中的氢被烃基取代后形成的一类有机化合物,简称「胺」。胺基(-NH2、-NHR、-NR2)是胺的官能团。如果氮原子连着羰基(C=O),那么该化合物则称为醯胺,其化学性质与胺并不相同。
注意:不建议将「胺」(amine)写成「氨」(ammonia),两者意义与英文名称不同。
胺的分類
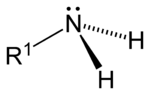
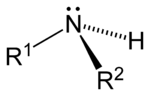
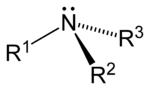
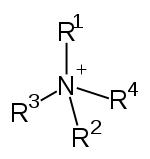
此外,胺還可根据氨分子上被取代的氫原子数量,順次分为伯胺(一級胺)、仲胺(二級胺)、叔胺(三級胺)。此外,还有季铵盐(四級铵鹽),可以看成是铵根离子(NH4+)的四个氫都被取代的产物。
| 一级胺 | 二级胺 | 三级胺 | 四级铵盐 |
|---|---|---|---|
| 伯胺 | 仲胺 | 叔胺 | 季铵盐 |
 |  |  |  |
物理性質
一级胺及二级胺的物理性质主要受氢键影响,然而因為氮與氫陰電性的差別(3.0-2.1=0.9)並無氫和氧間(3.5-2.1=1.4)那麼大,所以一般 N-H...H氫鍵較不像O-H...H鍵那麼強,故胺的沸点一般较相对的磷烃为高,却低于相对应的醇。 例如,
| 乙烷 | 甲胺 | 甲醇 | |
|---|---|---|---|
| 分子量 | 30 | 31 | 32 |
| 沸點 | -88 | -7 | 65 |
甲胺和乙胺在室温之下为气体,但甲醇和乙醇在室温之下为液体。甲醇與甲胺分子量相近,其沸點差異卻甚大。 幾乎所有胺類皆與水形成氫鍵,所以比同分子量的烴易溶於水,低分子量的胺類與水完全互溶,高分子胺類只適量溶於水。 气体胺带有一种类似氨的气味,液体胺则带有一种容易辨出的鱼腥味。
合成
鹵化物氨解(Ammonolysis of halides)
氨或胺氮上有孤对电子,作为亲核试剂与卤代烷发生亲核取代反应,按SN2机理进行。許多有機鹵化物以氨水溶液或氨溶液處理則變成胺類:
- RX + NH3 → RNH3 + X-
- RNH3+X- + NH3 → RNH2 + NH4+ + X-
- (X為鹵素)
用醇制备
胺的主要合成方法是氨的烷基化。工业上使用醇与氨合成有机胺:
- ROH + NH3 → RNH2 + H2O
这些反应需要使用催化剂、特制仪器及额外纯化,因为得到的是一、二、三级胺的混合物,需要提高反应的选择性。
其它方法
其它胺合成方法见下表:
| 反应名称 | 原料 | 注释 |
|---|---|---|
| 盖布瑞尔伯胺合成反应 | 卤代烷 | 试剂:邻苯二甲醯亚胺。制备一级胺的高选择性方法。 |
| 施陶丁格反应 | 叠氮化物 | 也可使用还原剂四氢铝锂。 |
| 施密特反应 | 羧酸 | |
| Aza-Baylis–Hillman反应 | 亚胺 | 烯丙基胺的合成 |
| 霍夫曼降解 | 醯胺 | 只适用于制备一级胺,并且不会有二三级胺副产物。 |
| 霍夫曼消除反应 | 季铵盐 | 强碱处理得季铵碱,再消除 |
| 醯胺还原 | 醯胺 | 醯胺被强还原剂如四氢铝锂还原 |
| 腈催化加氢 | 腈 | |
| 硝基化合物的还原 | 硝基化合物 | 还原剂可以是锌,锡,铁,在酸溶液中 |
| 德尔宾反应 | 卤代烃 | 试剂六亚甲基四胺 |
| Buchwald–Hartwig偶联反应 | 卤代芳香烃 | 合成芳胺的重要方法。 |
| 门秀金反应 | 叔胺 | 生成季铵盐 |
| 胺加成 | 烯烃与炔烃 | |
| Hofmann–Löffler–Freytag反应 | N-卤代胺 |
参考资料
- 邢其毅等.《基础有机化学》第三版 下册.北京:高等教育出版社,2005年.ISBN 978-7-04-017755-8
参见
- 醯胺
- 醯亚胺
- 亚胺
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.


