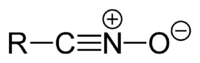
腈
C≡N基团称作氰基,在 -CN 基团中碳原子和氮原子通过三键键合在一起。无机化学中带有此官能团者為氰,而不称“腈”。[3]
[1](英語:),指的是带有C≡N官能团的有机化合物[2]。
许多含氰基的化合物都具有高毒性。
历史
氢氰酸首次由卡尔·威廉·舍勒于1782年成功合成。[4] 1811年,由约瑟夫·路易·盖-吕萨克合成出纯净的氢氰酸,这是一种剧毒且具挥发性的酸。氰基苯甲酸首先由弗里德里希·维勒和尤斯图斯·冯·李比希合成,但是由于当时的合成收率很低结果没有得到其理化数据,也没有得到它的假定结构。泰奥菲勒-朱尔·皮乐茨于1834年合成出了丙腈并且假设此化合物是一个含有氢氰酸的醚类化合物。[5] Hermann Fehling于1844年通过加热苯甲酸铵合成了苯腈,这是首个获得足够量以用于化学研究合成方法。 他通过加热甲酸铵的结果比对得到的物质以确定该结构。他为该新发现的化合物命名为腈,而这也成为了官能团的名称。[6]
合成
工业中, 主要合成腈的方法是氨氧化和氢氰化。这两种路线都符合绿色化学,因为在反应中不会产生等当量的盐。在氨氧化反应中,烃分子在氨的存在下被部分氧化,这个转化被用于大量的合成丙烯腈。[7]
- CH3CH=CH2 + 3/2 O2 + NH3 → NCCH=CH2 + 3 H2O
- CH2=CH-CH=CH2 + 2 HCN → NC(CH2)4CN
在许多特殊的应用中,腈还可以通过下列方法进行合成:
- 脂肪族亲核取代反应:在Kolbe腈合成中,卤代烃和金属氰化物(氰盐)反应。芳香腈通过Rosenmund-von Braun合成法制备。
- 通过一级酰胺的脱水制备腈。许多试剂都可以用来作为脱水试剂:二氯磷酸甲酯和DBU的组合试剂就是其中的一种。
 酰胺的脱水反应
酰胺的脱水反应
- 图例为一项研究中,一个芳香或脂肪醛和羟氨、无水硫酸钠在无溶剂反应中,通过微波反应历经肟中间体合成腈化合物。[9]
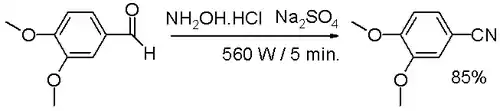 醛由一锅法制备腈
醛由一锅法制备腈
- 从芳香羧酸合成腈(Letts腈合成)。
- 在Sandmeyer反应中,芳香腈从偶氮化合物合成。
- 一个引入氰基的商业化试剂:氰基二乙基铝(Et2AlCN)可以通过三乙基铝和HCN合成。[10].这个试剂被用于对酮类的亲核加成反应。[11] 例如其应用:Kuwajima紫杉醇全合成。
- 氰离子很容易让二溴化合物发生偶联反应。α,α'-二溴己二酸与氰化钠在乙醇当中反应得到氰基环丁烷:[12]
 氰基诱导的偶联反应
氰基诱导的偶联反应
- 在Franchimont反应(A. P. N. Franchimont,1872年)中,一个α-溴代羧酸在氰基水解和脱羧反应后发生了二聚反应。[13]
反应
氰基基团可以在不同的的条件和试剂中进行不同的反应,包括:水解反应、氢化反应、还原反应或者成为离去基团(氰基)而进行取代反应。
水解反应
水解腈RCN在酸性或者碱性条件下会经过不同的水解历程,得到酰胺 RC(=O)NH2然后继续水解再得到羧酸RCOOH。腈的水解被普遍认为是制备羧酸的最佳方法之一。然而这些酸、碱催化的反应对于制备酰胺都有一定的局限性。主要的局限性在于:无论是酸或碱催化的反应,最终中和过程会导致大量的氰盐生成,从而引起污染问题。
腈完全水解的方程式为:[16]
- RCN + 2 H2O + HCl —Δ→ RCOOH + NH4Cl
- RCN + H2O + NaOH —Δ→ RCOONa + NH3
还原反应
在有机还原反应中,腈通过氢气和镍催化剂进行还原,产物是一个氨。(参见腈的还原)。腈还原成亚胺然后进行水解反应得到醛,即Stephen醛合成。
亲核反应
氰基碳原子是一个亲核中心,因此可以发生亲核加成反应:
烷基化反应
去质子的氰基能作为强有力的亲核试剂而用于烷基化亲电试剂,这里关键在于氰基离子 CN 的较小位阻和它独特的稳定性。这些特性都使得高位阻碳-碳键的合成可以理想的通过腈中间体来达成,因此腈中间体广泛的应用于合成药物靶分子和医药原料。[18]
有机氨基腈
氨基腈(Cyanamides)是一种N-氰基的化合物,具有通式:R1R2N-CN,它相似于无机化合物氰胺(cyanamide)。
腈氧化物
腈氧化物具有通式R-CNO。
注釋
参考文献
- 《化學命名原則》第四版 页面存档备份,存于第167頁
- IUPAC Gold Book nitriles
- NCBI-MeSH Nitriles
- David T. Mowry. ( – Scholar search). Chemical Reviews. 1948, 42 (2): 189–283. doi:10.1021/cr60132a001.
- J. Pelouze. . Annalen der Chemie und Pharmacie. 1834, 10 (2): 249. doi:10.1002/jlac.18340100302.
- Hermann Fehling. . Annalen der Chemie und Pharmacie. 1844, 49 (1): 91–97. doi:10.1002/jlac.18440490106.
- Peter Pollak, Gérard Romeder, Ferdinand Hagedorn, Heinz-Peter Gelbke "Nitriles" Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a17_363
- Chun-Wei Kuo, Jia-Liang Zhu, Jen-Dar Wu, Cheng-Ming Chu, Ching-Fa Yao and Kak-Shan Shia. . Chem. Commun. 2007, 2007 (3): 301–303. PMID 17299646. doi:10.1039/b614061k.
- Sharwan K, Dewan, Ravinder Singh, and Anil Kumar. (PDF). Arkivoc. 2006: (ii) 41–44 [2011-03-06]. (原始内容 (open access)存档于2007-09-26).
- W. Nagata and M. Yoshioka (1988). "Diethylaluminum cyanide". Org. Synth.; Coll. Vol. 6: 436.
- W. Nagata, M. Yoshioka, and M. Murakami (1988). "PREPARATION OF CYANO COMPOUNDS USING ALKYLALUMINUM INTERMEDIATES: 1-CYANO-6-METHOXY-3,4-DIHYDRONAPHTHALENE". Org. Synth.; Coll. Vol. 6: 307.
- Reynold C. Fuson, Oscar R. Kreimeier, and Gilbert L. Nimmo. . J. Am. Chem. Soc. 1930, 52 (10): 4074–4076. doi:10.1021/ja01373a046.
- Franchimont Reaction
- Über eine neue Methode zur Darstellung cyclischer Nitrile durch katalytischen Abbau (I. Mitteil.) (p 2464-2472) J. Houben, Walter Fischer Berichte der deutschen chemischen Gesellschaft (A and B Series) Volume 63, Issue 9 , Pages 2464 - 2472 doi:10.1002/cber.19300630920
- http://www.drugfuture.com/OrganicNameReactions/ONR197.htm Merck & Co., Inc., Whitehouse Station
- 羧酸的制备——腈水解. 北京中医药大学远程教育学院
- Smith, Andri L.; Tan, Paula. . J. Chem. Educ. 2006, 83: 1654. doi:10.1021/ed083p1654.
- Tetrahedron Volume 61, Issue 4, 24 January 2005, Pages 747-789 doi:10.1016/j.tet.2004.11.012
- The reductive decyanation reaction: chemical methods and synthetic applications Jean-Marc Mattalia, Caroline Marchi-Delapierre, Hassan Hazimeh, and Michel Chanon Arkivoc (AL-1755FR) pp 90-118 2006 Article
- Yoshiaki Nakao, Akira Yada, Shiro Ebata, and Tamejiro Hiyama. . J. Am. Chem. Soc. (Communication). 2007, 129 (9): 2428–2429. PMID 17295484. doi:10.1021/ja067364x.