河魨毒素
河魨毒素(英語:,縮寫:TTX)是一種強力的神經毒素,目前並沒有有效的解毒劑,它會和神經細胞的細胞膜上的快速鈉離子通道結合,令神經中的動作電位受阻截[1]。
| 河魨毒素 | |
|---|---|
 | |
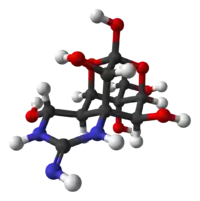 | |
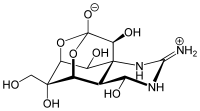
| IUPAC名 (4R,4aR,5R,6S,7S,8S,8aR,10S,12S)-2-azaniumylidene-4,6,8,12-tetrahydroxy-6-(hydroxymethyl)-2,3,4,4a,5,6,7,8-octahydro-1H-8a,10-methano-5,7-(epoxymethanooxy)quinazolin-10-olate | |
| 别名 | anhydrotetrodotoxin, 4-epitetrodotoxin, tetrodonic acid, TTX |
| 识别 | |
| CAS号 | 4368-28-9 |
| PubChem | 11174599 |
| ChemSpider | 9349691 |
| SMILES |
|
| InChI |
|
| InChIKey | CFMYXEVWODSLAX-QOZOJKKEBM |
| ChEBI | 9506 |
| KEGG | C11692 |
| 性质 | |
| 化学式 | C11H17N3O8 |
| 摩尔质量 | 319.27 g·mol−1 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
它的名字來自魨形目,因為此目下的魚類大多帶有這種毒素,包括河魨、翻車魨及鱗魨等。雖然這種毒素常見於這些魚類和其他生物體內,事實上它是由魚類體內一種名爲河魨毒素假交替單胞菌()的細菌所產生,其作用原理在1964年由美國杜克大學的楢橋敏夫和約翰·威爾遜·摩爾通過蔗糖间隙电压钳技術發現。[2]
自然界中的河魨毒素
河魨毒素存在於不同動物中,如漬螈屬(Taricha)蠑螈的卵中(毒素名為“tarichatoxin”,已廢用)、鸚哥魚、斑蟾、藍圈章魚(毒素名為“maculotoxin”)、海星、神仙魚、扁形蟲、箭蟲、紐蟲、橡子织纹螺和石蟹等。
動物利用毒素來保護自己免被獵食,或同時作為防禦及獵食的武器(如章魚、箭蟲及紐蟲等)。在1964年和1978年,Tarichatoxin 和 Maculotoxin 分別被證實就是河魨毒素。近年有研究發現藍圈章魚體內的細菌也會產生這種毒素[3]。
河魨毒素的最常見來源是弧菌,如溶藻弧菌就是最常見的一種。河魨[4]、箭蟲[5]和紐蟲[6]的體內都同時含有溶藻弧菌和河魨毒素。
生化學
河魨毒素會和又稱「第一部位」(Site 1)的快速鈉陽離子通道結合。第一部位位於離子通道的細胞外部份。任何分子與這部份結合都會暫時停止離子通道的功能。石房蛤毒素和芋螺毒素也是和這個部份發生作用。
這種毒素在生化學上說明人體內的兩種不同類型的鈉離子通道:感TTX鈉離子通道(TTX-s Na+ channel)和抗TTX鈉離子通道(TTX-r Na+ channel)。 河魨毒素和感TTX鈉離子通道的親合力是5-15 納摩爾,而河魨毒素和抗TTX鈉離子通道的親合力極低。含有抗TTX鈉離子通道的神經元主要位於心臟組織,而其餘的神經元通常為感TTX鈉離子通道。由於感TTX鈉離子通道在中樞神經系統的普遍分佈,在細胞培養技術中河魨毒素主要用於靜止信息傳遞。
生理反應
河魨毒素截斷人體肌肉細胞中的快速鈉陽離子流,因而抑制肌肉收縮。相對之下,心臟的節律細胞的鈉離子通道是慢離子流,於是心瓣的動作電位並沒有被毒素攔截。所以中河魨毒素的人的死因並非心臟節律電流受阻,而是肌肉麻痺。
醫學用途
阻礙快速鈉陽離子通道是治療心律不正常的一種可能的途徑。研究證實河魨毒素能減低(在1930年代在日本使用)因不同病症如末期癌症[7]、偏頭痛和停止吸食海洛英所引起的痛楚。
中毒
河魨毒素中毒主要由進食魨形目魚類引致。河魨的皮膚和內臟均含有河魨毒素,份量有可能足以令橫膈膜麻痺而引致呼吸困難甚至致死。然而毒素的份量和毒性因魚類品種、季節、地區而異,很多河魨肉含有的毒性並不致死。因為河豚素不能越過大腦中血液細胞的屏障,所以中毒者會在大腦清醒的情況下感受到無助的痛苦。儘管如此,進食接近致命的份量後,服用者可能處於瀕死狀態數日且持續保持知覺,因此河魨毒素一直被認為是海地巫毒的一種巫術材料和現實中會令人最接近喪屍狀態的一種毒劑。
歷史
河魨毒素中毒的最早國外歷史記載是英國航海家詹姆斯·庫克的日記。他記載道他的船員進食過一些本地熱帶魚類(河魨)後,將廚餘及剩飯餵給船上飼養的豬。船員後來出現麻痺和呼吸困難等症狀,而所有豬隻則在翌日全部死亡。現在看來,船員進食過含有少量河魨毒素的河魨肉,而豬隻則進食了含有大量毒質的河魨內臟而死亡。[15] 晉代左思《吳都賦》中有「王鮪鯸鮐」之句,劉淵林注曰:「鯸鮐魚,狀如蝌蚪,大者尺余,腹下白,背上青黑,有黃紋,性有毒。」唐人段成式《酉陽雜俎》雲:「(魚臣)魚肝與子俱毒。」宋人沈括在《夢溪筆談》中說:「吳人嗜河豚魚,有遇毒者,往往殺人,可為深戒。」同時期的《太平廣記》亦云:「鯸鮐魚文斑如虎,俗云煮之不熟,食者必死。」《本草綱目》記載:「河豚有大毒,味雖珍美,修治失法,食之殺人」、「豚,言其味美也。侯夷,狀其形丑也」。
河魨毒素在1909年由日本科學家田原良純(Yoshizumi Tahara)博士發現並命名。
診斷
河魨毒素中毒的診斷主要基於觀察病徵和最近飲食紀錄,病徵通常在攝取後30分鐘內出現,而最遲可在四小時後,而服用者可於17分鐘內致死。[15]病徵為嘴唇及舌頭麻木以致流涎、出汗、頭痛、無力、昏睡、運動失調、四肢不協調、顫抖、癱瘓、發紺、失聲、吞嚥困難、呼吸困難、支氣管粘液溢(多痰)、支氣管痙攣昏迷、低血壓等。消化道的徵狀通常較嚴重,包活噁心、嘔吐、腹瀉及腹痛等。完全的呼吸衰竭和心臟衰竭之前可能出現心律失常。
治療
首要治療手段為持續性地維持呼吸和心跳,直至中毒者恢復至可自行呼吸為止;靜脈注射α-腎上腺素促劑去平衡低血壓。抗膽鹼酯酶藥會因多樣效果而使用。現時此毒素是沒有直接有效的解毒劑,因為毒素和神經細胞是迅速反應而產生的強化學鍵難以輕易分解,所以通常都持續作呼吸和心跳維持直至身體自然排走毒素為止。
不同地區的中毒個案統計
河魨毒素中毒幾乎都是因進食印度洋和太平洋等地的河魨引起。有零星的中毒報告,包括致死,懷疑是因進食大西洋、墨西哥灣及加利福尼亞灣的河魨。然而卻沒有任何因進食大西洋的「斑點圓魨」(學名:Sphoeroides maculatus)而中河魨毒素的確診個案。不過在三項研究中發現,該魚對老鼠是高度毒性的。佛羅里達的最近數宗服食這種魚而中毒的個案證實是石房蛤毒素中毒,雖然其中毒徵狀極相似。白法螺(學名:Charonia sauliae)被列為有毒食物,而已證實這種海產體內含有河魨毒素的衍生物。亦有不少個案是河魨被錯誤標籤而造成誤服中毒的個案。在美國奧勒崗州有人生吞了一條粗皮漬螈(學名:Taricha granulosa)而中毒致死。
進食河魨毒素中毒的統計
從1974到1983年間,日本有646個河魨毒素中毒的病例,其中179人因此死亡。估計每年約200宗個案,其中50%致死。而在美國只有少數的個案,而印度洋及太平洋國度以外的個案則更少。但海地當地因為以河魨毒素作為喪屍的巫毒材料,所以中毒者數量較鄰近地區高很多[16]。
受害人口
河魨毒素中毒偏向於特定國家並不是因為基因因素。不進食已知有毒品種的海產(主要為河魨,其他帶毒品種幾乎無人食用)可避免河魨毒素中毒。然而河魨毒素中毒卻是日本社會的公眾健康問題,因為河魨()在日本料理中是傳統佳餚。只有特許的餐店方可製作及出售河魨料理。受過訓練及領有牌照的料理師傅會小心翼翼地切除河魨的盲腸,以減少毒素含量。但是有可能被誤認或錯誤標籤,尤其是冰鮮魚及其製品。
管制
在美國,河魨毒素列入美國疾病控制與預防中心的受管制藥物(Select Agents)目錄中[17],科學研究員必須向美國衛生及公共服務部註冊,方可使用河魨毒素作研究用途。然而,研究者若持有少於100毫克則不在此限[18]。
參考
- Hwang DF, Noguchi T. . Adv. Food Nutr. Res. 2007, 52: 141–236. PMID 17425946. doi:10.1016/S1043-4526(06)52004-2.
- Narahashi T, Moore JW, Scott WR. . The Journal of General Physiology. May 1964, 47 (5): 965–74. PMC 2195365. PMID 14155438. doi:10.1085/jgp.47.5.965.
- Hwang DF, Arakawa O, Saito T, Noguchi T, Simidu U, Tsukamoto K, Shida Y, Hashimoto K. . Marine Biology. 1989, 100 (3): 327–332. doi:10.1007/BF00391147.
- Noguchi, T., Hwang, D. F., Arakawa, O., Sugita, H., Deguchi, Y., Shida, Y. & Hashimoto, K. 1987 Vibrio alginolyticus, a tetrodotoxin-producing bacterium, in the intestines of the fish Fugu vermicularis vermicularis. Marine Biology 94, 625-630.
- Thuesen, E. V. & Kogure, K. 1989 Bacterial production of tetrodotoxin in four species of Chaetognatha. Biological Bulletin 176, 191-194.
- Carroll, S., McEvoy, E. G. & Gibson, R. 2003 The production of tetrodotoxin-like substances by nemertean worms in conjunction with bacteria. Journal of Experimental Marine Biology and Ecology 288, 51-63.
- Hagen NA, du Souich P, Lapointe B, Ong-Lam M, Dubuc B, Walde D, Love R, Ngoc AH; on behalf of the Canadian Tetrodotoxin Study Group. . J Pain Symptom Manage. 2008. PMID 18243639. doi:10.1016/j.jpainsymman.2007.05.011.
- Aratani M, Fukuyama T, Nakatsubo F, Goto T, Inoue S, Tanino H, Sugiura S, Kakoi H. . J. Am. Chem. Soc. 1972, 94 (26): 9217–9219. doi:10.1021/ja00781a038.
- Kishi Y, Fukuyama T, Aratani M, Nakatsubo F, Goto T, Inoue S, Tanino H, Sugiura S, Kakoi H. . J. Am. Chem. Soc. 1972, 94 (26): 9219–9221. doi:10.1021/ja00781a039.
- Ohyabu N, Nishikawa T, Isobe M. . J. Am. Chem. Soc. 2003, 125 (29): 8798–8805. doi:10.1021/ja0342998.
- Nishikawa T, Urabe D, Isobe M. . Angewandte Chemie International Edition. 2004, 43 (36): 4782 – 4785. doi:10.1002/anie.200460293.
- Douglass Taber. . Organic Chemistry Portal. [2007-10-13]. (原始内容存档于2007-10-13).
- Hinman A, Du Bois J. . J. Am. Chem. Soc. 2003, 125 (38): 11510 –11511. doi:10.1021/ja0368305.
- Material Safety Data Sheet Tetrodotoxin ACC# 01139 https://fscimage.fishersci.com/msds/01139.htm 页面存档备份,存于
- Clark RF, Williams SR, Nordt SP, Manoguerra AS. . Undersea Hyperb Med. 1999, 26 (3): 175–84 [2008-08-12]. PMID 10485519. (原始内容存档于2011-08-11).
- Anderson WH. . Journal of Ethnopharmacology. 1988, 23 (1): 121–6. PMID 3419200. doi:10.1016/0378-8741(88)90122-5.
- HHS and USDA Select Agents and Toxins 7 CFR Part 331, 9 CFR Part 121, and 42 CFR Part 73. http://www.cdc.gov/od/sap/docs/salist.pdf 页面存档备份,存于
- Federal Register. Vol. 70, No. 52. Friday, March 18, 2005. http://www.cdc.gov/od/sap/42_cfr_73_final_rule.pdf 页面存档备份,存于
