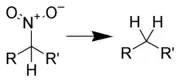
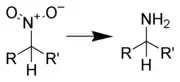
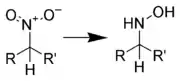
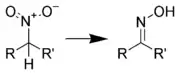
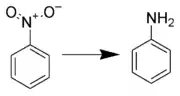
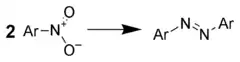
硝基化合物的还原反应
硝基化合物的还原反应是一种可通过诸多不同试剂和不同反应条件进行的化学反应。由于硝基的还原反应非常容易发生,因此历史上硝基是首批被发现可发生还原反应的基团之一。
脂肪族硝基化合物与芳香族硝基化合物在还原反应上表现出较大的差异,因此可将这类反应分类为:脂肪族硝基化合物的还原反应与芳香族硝基化合物的还原反应,第二级分类则通过还原试剂的种类进行分类。
脂肪族硝基化合物
芳香族硝基化合物
芳香硝基化合物的还原反应通常收率很高,并可用于多种有机化合物的合成反应,相比脂肪族硝基化合物的还原反应,芳香族硝基化合物的还原反应更具应用意义。
参考文献
- M. J. Guttieri and W. F. Maier. . J. Org. Chem. 1984, 49 (16): 2875–2880. doi:10.1021/jo00190a006.
- A. T. Nielsen. . J. Org. Chem. 1962, 27 (6): 1998–2001. doi:10.1021/jo01053a019.
- Dauben, Jr., H. J.; Ringold, H. J.; Wade, R. H.; Pearson, D. L.; Anderson, Jr., A. G. (1963). "Cycloheptanone". Org. Synth.; Coll. Vol. 4: 221.
- Senkus, M. 40: 506. 1948.
- A. S. Kende and J. S. Mendoza. . Tetrahedron Letters. 1991, 32 (14): 1699–1702. doi:10.1016/S0040-4039(00)74307-3.
- A. Burger, M. L. Stein and J. B. Clements. . J. Org. Chem. 1957, 22 (2): 143–144. doi:10.1021/jo01353a010.
- H. Feuer, R. S. Bartlett, B. F. Vincent and R. S. Anderson. . J. Org. Chem. 1965, 30 (9): 2880–2882. doi:10.1021/jo01020a002.
- Braun, V. J.; Sobecki, W. . Ber. 1911, 44 (3): 2526–2534. doi:10.1002/cber.19110440377.
- J. R. Hanson and E. Premuzic. . Tetrahedron. 1967, 23 (10): 4105–4110. doi:10.1016/S0040-4020(01)97921-9.
- C. Grundmann. . Angewandte Chemie. 1950, 62 (23-24): 558–560. doi:10.1002/ange.19500622304.
- Bavin, P. M. G. (1973). "2-Aminofluorene". Org. Synth.; Coll. Vol. 5: 30.
- Allen, C. F. H.; VanAllan, J. (1955)). "2-Amino-p-cymene". Org. Synth.; Coll. Vol. 3: 63.
- Fox, B. A.; Threlfall, T. L. (1973). "2,3-Diaminopyridine". Org. Synth.; Coll. Vol. 5: 346.
- Redemann, C. T.; Redemann, C. E. (1955). "5-Amino-2,3-dihydro-1,4-phthalazinedione". Org. Synth.; Coll. Vol. 3: 69.
- Faul, Margaret M.; Thiel, Oliver R. . . Encyclopedia of Reagents for Organic Synthesis. 2005. ISBN 9780470842898. doi:10.1002/047084289X.rt112.pub2.
- Basu, M. K. . Tet. Lett. 2000, 41 (30): 5603. doi:10.1016/S0040-4039(00)00917-5.
- Hartman, W. W.; Silloway, H. L. (1955). "2-Amino-4-nitrophenol". Org. Synth.; Coll. Vol. 3: 82.
- Ayyangar, N. R.; Brahme, K. C.; Kalkote, U. R.; Srinivasan, K. V. . Synthesis. 1984, 1984 (11): 938. doi:10.1055/s-1984-31027.
- Harman, R. E. (1963). "Chloro-p-benzoquinone". Org. Synth.; Coll. Vol. 4: 148.
- Kamm, O. (1941). "β-Phenylhydroxylamine". Org. Synth.; Coll. Vol. 1: 445.
- Bigelow, H. E.; Robinson, D. B. (1955). "Azobenzene". Org. Synth.; Coll. Vol. 3: 103.
- R. F. Nystrom and W. G. Brown. . J. Am. Chem. Soc. 1948, 70 (11): 3738–3740. doi:10.1021/ja01191a057.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.