钯
鈀(注音:ㄅㄚˇ,拼音:bǎ,英文:Palladium)是一種化學元素,化學符號為Pd,原子序為46。鈀是在1803年由威廉·海德·沃拉斯頓所發現的一種罕見而具有光澤的銀白色金屬。鈀的英文名稱是以小行星智神星來命名的。鈀與鉑、銠、釕、銥、鋨形成一組鉑族金屬的元素家族(PGMs)。鉑族金屬化學性質相似,但鈀的熔點最低,也是這些貴金屬中密度最低的一種。
鈀金屬,與它的同族元素鉑金屬,在現有的供給量當中,有一半以上被用在觸媒轉換器當中。這些觸媒轉換器能將汽機車排放廢氣中的90%的有害氣體(例如:一氧化碳、二氧化氮、碳氫化合物),轉換為毒害性較低的物質(例如:二氧化碳、氮氣、水)。鈀也常被使用在電子工業、牙醫學、醫學、氫氣純化、化學應用、地下水處理以及珠寶業。鈀能催化氫氣及氧氣反應產生水及熱,是燃料電池中關鍵的成分。
鈀及其他鉑族金屬的礦床很罕見。鈀含量較高的礦床主要分佈在:南非德蘭士瓦盆地的布希維爾德火成巖複合體的白雲帶、美國蒙大拿州的斯蒂爾沃特綜合體、加拿大安大略省的索德柏立盆地及珊德灣區、俄羅斯的諾里爾斯綜合體,近期更在菲律賓米沙鄢群島的北部發現。[2] 回收廢棄觸媒轉換器中的鈀也是其中一種來源。由於眾多的應用以及資源的有限性,引起了大量的投資興趣。
性质
鈀屬於週期表中第十族元素,但是他的最外層電子組態遵守洪德定則。位於s殼層中的電子會遷移填入較低能量之d軌域。
鈀是一種類似鉑的軟銀白色金屬,是鉑族金屬族當中密度及熔點最低的。退火時柔軟且具有延展性,冷加工時可提升強度和硬度。鉑可緩慢溶於濃硝酸、熱濃硫酸以及常溫之王水,並在精細研磨後可溶於鹽酸當中。[3] 鈀在標準溫度下不與氧反應,因此在空氣中不會失去光澤。加熱至800℃的鈀將產生一層氧化鈀,並且在含硫的潮濕空氣中會輕微褪色。[4]
在3.2K的低溫中以α粒子轟擊鈀膜將會使之產生缺陷,而表現出超導性。[5]
同位素
自然存在的鈀元素具有七種不同的同位素,其中六種是穩定存在的。最穩定的放射性同位素有:半衰期為650萬年的107鈀(可在自然界中找到)、半衰期為17天的103鈀以及半衰期為3.63天的100鈀。另外有發現18種鈀的放射性同位素,91鈀至123鈀,它們原子重量的分布在90.94948(64) amu(91鈀)至122.93426(64) amu (123鈀)。這18種同位素,除了101鈀 (半衰期為8.47小時)、109鈀 (半衰期為13.7小時) 及 112鈀 (半衰期為21小時)之外,其他的半衰期均小於30分鐘。[6]
若是同位素的原子質量單位小於自然存在中最穩定同位素(106鈀)的原子質量單位,該同位素最主要的衰變模式為電子捕獲,而主要的衰變產物為銠(Rh)。若是同位素的原子質量單位較106鈀大,其主要的衰變模式為β衰變( 貝他衰變),主要的衰變產物為銀(Ag)。
放射性107銀是107鈀的衰變產物,最早於1978年在聖塔克拉拉隕石中發現。發現者認為這種以鐵為核心的小行星之聚結和分化可能發生在核合成事件後之1000萬年。107鈀與銀之關聯性在自太陽系增生中已融化的物體中觀測到,證實早期太陽系中核種的短暫存在。[7]
化合物
钯化合物通常以0价和+2价两种价态存在,其它价态的化合物也是已知的。总体上来说,与其它元素相比,钯化合物的性质和铂更接近。
应用


钯在现代最大的用途是催化转换器[8],也能用作珠宝、牙科材料、[8][9]手表配件、血糖试纸、飞机火花塞、手术器械和电接触点,[10]或者用于制作专业的横向长笛。[11];也能用作商品(貴金屬),如钯金的ISO货币代码是XPD及964,其余有此类代码的金属还有金、银和铂。[12]钯能够吸收氢气,因此它也是1989年开始的有争议的冷聚变实验的关键组分。
诺里尔斯克镍公司(Norilsk Nickel)是俄罗斯最大的,同时也是世界最大的有色金属和贵金属生产商之一,其生产的钯占全球产量的66%。
催化
钯均匀负载时,如得到钯碳催化剂,可以用作多功能的催化剂,它可以加速氢化、脱氢以及裂化反应。有机化学中大部分碳-碳键的偶合反应都借助于钯化合物催化剂来完成,如赫克反应和铃木反应。
当钯分散到导电材料上时,可以得到优良的电催化剂,用于催化在碱性介质氧化伯醇。[13]在2010年,钯催化的有机反应获得了诺贝尔化学奖。另外,钯可用于均相催化,和多种配体结合,完成高选择性的化学转换,如钯催化剂用于催化的C−F键的反应。[14]
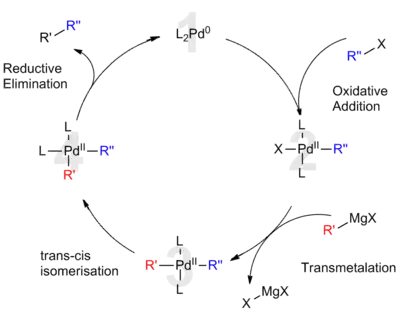
钯催化剂主要用于有机化学以及工业应用,它在合成生物学上也是有较好的前景。在2017年,钯纳米颗粒在哺乳动物体内被证实了有治疗疾病的催化活性。[16]
电子学
钯在电子学中的第二大应用便是用于电容器中,[17]其中钯以及钯银合金用作电极。[8]钯(或钯镍合金)可以用作消费电子产品中的连接部分、配件组分或焊接材料。[18][19]根据2006年莊信萬豐的报告,电子行业在当年耗用了107万金衡盎司(合33.2吨)的金属钯。[20]
储氢
钯在室温可以很容易地吸收氢气,形成氢化钯PdHx(x<1)。[21]虽然很多过渡金属也有这种性质,但钯可以高效地吸收氢气,并且在x接近1之前不会失去延展性。[22]钯的这一性质被用于高效、相对廉价且安全的氢储存设备的研究中,但钯本身的价格昂贵是必须要考虑的因素。[23]钯中的氢含量影响着磁化率,随着氢含量的增高,磁化率降低,并且在形成PdH0.62时变为零。在任意更高的比例下,固溶体变为具有抗磁性。[24]
牙医材料
钯在一些牙科汞齐有少量使用(约0.5%),它可用于减少腐蚀并增加最终修复体的金属光泽。[25]
注释
参考文献
- Magnetic susceptibility of the elements and inorganic compounds 的存檔,存档日期2011-03-03., in Handbook of Chemistry and Physics 81st edition, CRC press.
- NASA, together with USGS, (United States Geological Survey), released a 3-year study report detailing the 8,450 square kilometer palladium deposits lying below the seas of Visayan, Sibuyan, and Tablas Strait. Source: https://breakingphnews.blogspot.com/2016/05/biggest-palladium-deposits-found-in.html 页面存档备份,存于
- Hammond, C. R. . 81st. CRC press. 2004. ISBN 978-0-8493-0485-9.
- Craig, Bruce D.; Anderson, David S. . . ASM International. 1995: 126. ISBN 978-0-87170-518-1.
- B. Strizker, Phys. Rev. Lett., 42, 1769 (1979).
- . 2009-08-23 [12 November 2009].
- Chen, J. H.; Wasserburg, G. J. . Geochimica et Cosmochimica Acta. 1990, 54 (6): 1729–1743. Bibcode:1990GeCoA..54.1729C. doi:10.1016/0016-7037(90)90404-9.
- . United Nations Conference on Trade and Development. [2007-02-05]. (原始内容存档于2006-12-06).
- Rushforth, Roy. . Platinum Metals Review. 2004, 48 (1).
- Hesse, Rayner W. . . Greenwood Publishing Group. 2007: 146. ISBN 978-0-313-33507-5.
- Toff, Nancy. . Oxford University Press. 1996: 20. ISBN 978-0-19-510502-5.
- Weithers, Timothy Martin. . . 2006: 34. ISBN 978-0-471-73203-7.
- Tsuji, Jiro. . John Wiley and Sons. 2004: 90. ISBN 0-470-85032-9.
- Drahl, Carmen. . Chemical & Engineering News. 2008, 86 (35): 53–56. doi:10.1021/cen-v086n035.p053.
- Brown, William Henry; Foote, Christopher S; Iverson, Brent L. . . Cengage Learning. 2009: 270. ISBN 978-0-495-38857-9.
- Miller MA, Askevold B, Hannes M, Kohler RH, Pirovich D, Weissleder R. . Nature Communications. 2017, 8: 15906. Bibcode:2017NatCo...815906M. PMC 5510178. PMID 28699627. doi:10.1038/ncomms15906.
- Zogbi, Dennis. . TTI, Inc. 2003-02-03.
- Mroczkowski, Robert S. . McGraw-Hill Professional. 1998: 3–. ISBN 978-0-07-041401-3.
- Harper, Charles A. . McGraw-Hill Professional. 1997: 580–. ISBN 978-0-07-026698-8.
- Jollie, David. (PDF). Johnson Matthey. 2007. (原始内容 (PDF)存档于2008-02-16).
- Manchester, F. D.; San-Martin, A.; Pitre, J. M. . Journal of Phase Equilibria. 1994, 15: 62. doi:10.1007/BF02667685.
- Greenwood, N. N.; Earnshaw, A. 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- Grochala, Wojciech; Edwards, Peter P. . Chemical Reviews. 2004, 104 (3): 1283–316. PMID 15008624. doi:10.1021/cr030691s.
- Mott, N. F. and Jones, H. (1958) The Theory of Properties of metals and alloys. Oxford University Press. ISBN 0-486-60456-X. p. 200
- Colon, Pierre; Pradelle-Plasse, Nelly; Galland, Jacques. . Dental Materials. 2003, 19 (3): 232–9. PMID 12628436. doi:10.1016/S0109-5641(02)00035-0.
外部連結
- 元素钯在洛斯阿拉莫斯国家实验室的介紹(英文)
- —— {{LinkForElement|钯| }}(英文)
- 元素钯在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素钯在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – {{LinkForElement|钯| }}(英文)