草酸
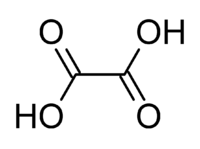
草酸(英文:Oxalic acid,全称酢浆草酸),也称乙二酸,是一種強有機酸,化學式為H2C2O4。常见的草酸通常含有两分子的结晶水(H2C2O4·2H2O)。草酸在菠菜和植物大黃中廣泛存在。
| 草酸 | |||
|---|---|---|---|
 | |||
| |||
 | |||
| IUPAC名 ethanedioic acid | |||
| 别名 | 乙二酸 | ||
| 识别 | |||
| CAS号 | 144-62-7(无水) 6153-56-6(二水) | ||
| PubChem | 971 | ||
| ChemSpider | 946 | ||
| SMILES |
| ||
| Beilstein | 385686 | ||
| Gmelin | 2208 | ||
| 3DMet | B00059 | ||
| UN编号 | 3261 | ||
| EINECS | 205-634-3 | ||
| ChEBI | 16995 | ||
| RTECS | RO2450000 | ||
| DrugBank | DB03902 | ||
| KEGG | C00209 | ||
| MeSH | Oxalic+acid | ||
| 性质 | |||
| 化学式 | H2C2O4(无水) C2H2O4·2H2O(二水) | ||
| 摩尔质量 | (无水)90.03 g/mol (二水)126.07 g·mol⁻¹ | ||
| 外观 | 白色晶体 | ||
| 密度 | 1.90 g/cm³(无水) 1.653 g/cm³(二水) | ||
| 熔点 | 101-102 °C(二水) | ||
| 溶解性(水) | 9.5 g/100 mL(15 °C) 14.3 g /100 mL(25 °C?) 120 g/100 mL(100 °C) | ||
| pKa1 | 1.38 | ||
| pKa2 | 4.28 | ||
| 危险性 | |||
| MSDS | External MSDS | ||
| 主要危害 | 腐蚀性 | ||
| NFPA 704 |
 1
3
0
| ||
| 闪点 | 166°C | ||
| 相关物质 | |||
| 相关化学品 | 草酰氯、草酸钠 草酸钙、草酸苯酯、草酸二乙酯 | ||
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |||
化学性质
還原性
乙二酸有很強的還原性,能被氧化劑氧化成CO2。例如草酸+氧生成二氧化碳和水 2HOOC-COOH + O2 → 4CO2 + 2H2O
乙二酸可以使KMnO4褪色,這個反應可以用來滴定KMnO4濃度,可以洗去溅在布条上的墨水迹。
製備
- 4 ROH + 4 CO + O2 → 2(CO2R)2 + 2 H2O
用途
在化学工业上用以制造季戊四醇、草酸钴、草酸镍、碱性品绿,钢铁、土壤分析成套试剂、化学试剂等。快速染料用作显色助染剂。稻草、麦杆制品的漂白剂(草酸有还原性),铁锈污染消除剂(草酸与氧化铁作用,生成可溶性的草酸铁,容易被水洗去,故可除去织物上所沾染的铁迹)。
安全性
草酸是一種存在於許多植物的酸,但也是一種腎毒性和腐蝕性的酸性有毒物質。純草酸的半致死劑量(LD50),以對大鼠的影響作計量,大約為每公斤體重375毫克 [2],換算至一個約65公斤的人,大約需要25公克的份量。另外,口服的最低致死劑量(LDLo)約為600mg/kg [3]。草酸有著非常刺激性的味道,長久接觸草酸的水溶液,可引致關節痛。在一般人的尿液裡,亦含有微量草酸,份量大約有數毫克[4]。草酸對混凝土、木材及玻璃均具腐蝕性[5]。
參考資料
- . [2015年11月30日]. (原始内容存档于2018年4月30日).
- . [2010-01-12]. (原始内容存档于2008-10-16).
- Safety Officer in Physical Chemistry. . 牛津大學出版社. 2005-08-13 [2009-12-03]. (原始内容存档于2010-01-07).
- Wilhelm Riemenschneider, Minoru Tanifuji "Oxalic Acid" in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi: 10.1002/14356007.a18_247
- . [2010-01-12]. (原始内容存档于2010-04-13).
参见
- 草酸盐
- 草酸盐中毒
外部連接
| 维基共享资源中相关的多媒体资源:Oxalic acid |
- Oxalic acid MS Spectrum 页面存档备份,存于
- 国际化学品安全卡0529
- NIOSH Guide to Chemical Hazards (CDC) 页面存档备份,存于
- Table: Oxalic acid content of selected vegetables (USDA)
- Alternative link: Table: Oxalic Acid Content of Selected Vegetables (USDA) 页面存档备份,存于
- About rhubarb poisoning (The Rhubarb Compendium)
- Oxalosis & Hyperoxaluria Foundation (OHF) The Oxalate Content of Food 2008 (PDF)
- Oxalosis & Hyperoxaluria Foundation (OHF) Diet Information
- Calculator: Water and solute activities in aqueous oxalic acid 页面存档备份,存于
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.


