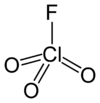
高氯酰氟
高氯酰氟[5]是具有化学式ClFO
3的活泼气体,具有类似于汽油和煤油的独特甜味[6]。有毒,是一种强大的氧化剂和氟化剂。是高氯酸的酸性氟化物 。
| 高氯酰氟 | |||
|---|---|---|---|
| |||
| IUPAC名 Perchloryl fluoride | |||
| 别名 | Chlorine oxyfluoride, Perchlorofluoride, Chlorine fluorine oxide, Trioxychlorofluoride, Perchloric acid fluoride | ||
| 识别 | |||
| CAS号 | 7616-94-6 | ||
| PubChem | 24258 | ||
| ChemSpider | 22680 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | XHFXMNZYIKFCPN-UHFFFAOYAO | ||
| EINECS | 231-526-0 | ||
| RTECS | SD1925000 | ||
| 性质 | |||
| 化学式 | ClO3F | ||
| 摩尔质量 | 102.4496 g/mol g·mol⁻¹ | ||
| 外观 | 无色气体 | ||
| 氣味 | 甜味 | ||
| 密度 | 1.434 g/cm3 | ||
| 熔点 | −147.8 °C(125 K) | ||
| 沸点 | −46.7 °C(226 K) | ||
| 溶解性(水) | 0.06 g/100 ml (20 °C) | ||
| 蒸氣壓 | 10.5 atm (20°C)[1] | ||
| 黏度 | 3.91 x 10−3 Pa.s (@ melting point) | ||
| 结构 | |||
| 分子构型 | 四面体[2]:373 | ||
| 热力学 | |||
| ΔfHm |
-21.42 kJ/mol [3]:380 | ||
| S |
278.97 J/(mol*K) | ||
| 危险性 | |||
| 主要危害 | 腐蚀性,氧化性,毒性 | ||
| NFPA 704 |
 0
3
3
| ||
| PEL | TWA 3 ppm (13.5 mg/m3)[1] | ||
| TLV | 3 ppm | ||
| 致死量或浓度: | |||
LC50(中位浓度) |
385 ppm (rat, 4 hr) 451 ppm (dog, 4 hr)[4] | ||
LCLo(最低) |
2000 ppm (rat, 40 min) 451 ppm (dog, 4 hr)[4] | ||
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |||
尽管高氯酰氟的生成焓( ΔHf°=-5.2千卡/摩尔)很小,但它是热力学稳定的,在400℃才分解。[2]:380对还原剂和阴离子具有很强的反应性,但氯原子充当亲电体。 :382 与还原剂如金属酰胺、金属、氢化物等发生爆炸性反应[6]。与氯化氟化物不同,其在水中的水解非常缓慢。
合成与化学
高氯酰氟主要由氟化高氯酸盐产生。常用五氟化锑作为氟化剂: [2]:372–373
- ClO−
4 + 3 HF + 2 SbF
5 → ClO
3F + H
3O+
+ 2 SbF−
6
ClO
3F与醇反应生成烷基高氯酸盐,这是对震动极其敏感的炸药。 [7] 在路易斯酸存在下,它可用于通过亲电芳香取代将–ClO
3基团引入芳香环。 [8]
应用
高氯酰氟在有机化学中用作温和的氟化剂。[2] :383 它是第一种工业上的亲电氟化剂,自20世纪60年代起用于生产氟化类固醇。[7] 在氯化铝存在下,它也被用作芳族化合物的亲电子高氯化试剂。[9]
研究了高氯酰氟作为高性能液体火箭燃料氧化剂的用途。[10] 与五氟化氯和五氟化溴相比,它具有明显更低的比冲 ,但不会腐蚀容器。 不需要低温储存。 火箭燃料化学家John Drury Clark在他的书《Ignition!》中报道称 [11]高氯酰氟与全卤素氧化剂如三氟化氯和五氟化氯完全混溶,这种混合物提供了适当燃烧含碳燃料所需的氧气。
它也可以作用于光電火焰光度計的激发源。 [12]
安全
高氯酰氟氟化物是有毒的,TLV为3ppm。[13] 它对肺和眼睛具有强烈的刺激性,能够灼伤暴露的皮肤。其IDLH水平为100 ppm。[14] 接触的症状包括头晕、头痛、晕厥和紫绀。 暴露于毒性水平会导致严重的呼吸道炎症和肺水肿。[10]
参考文献
- NIOSH Pocket Guide to Chemical Hazards 0490
- Harry Julius Emeléus; A. G. Sharpe. . Academic Press. 1976. ISBN 0-12-023618-4.
- . . 2018 [2019-08-24]. (原始内容存档于2020-06-03).
- . Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- Chemical Science and Technology Laboratory. . National Institute of Standards and Technology. [2009-11-28]. (原始内容存档于2020-06-03).
- Jared Ledgard. 3rd. Lulu.com. 2007: 77. ISBN 0-615-14290-7.
- Peer Kirsch. . Wiley-VCH. 2004: 74. ISBN 3-527-30691-9.
- Peter Bernard David De la Mare. . CUP Archive. 1976: 63. ISBN 0-521-29014-7.
- Inman, C. E.; Oesterling, R. E.; Tyczkowski, E. A. . Journal of the American Chemical Society. 1958-10-01, 80 (19): 5286–5288. ISSN 0002-7863. doi:10.1021/ja01552a069.
- John Burke Sullivan; Gary R. Krieger. 2nd. Lippincott Williams & Wilkins. 2001: 969. ISBN 0-683-08027-X.
- (PDF). [2019-08-24]. (原始内容存档 (PDF)于2019-07-16).
- Schmauch, G. E.; Serfass, E. J. . Applied Spectroscopy. 1958, 12 (3): 98–102. Bibcode:1958ApSpe..12...98S. doi:10.1366/000370258774615483.
- National Institute for Occupational Safety and Health. . Centers for Disease Control and Prevention. [2013-10-31]. (原始内容存档于2013-11-03).
- National Institute for Occupational Safety and Health. . Centers for Disease Control and Prevention. [2013-10-31]. (原始内容存档于2013-11-03).
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.