菊油环酮
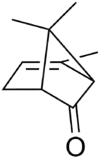
菊油环酮,IUPAC名为2,7,7-三甲基双环[3.1.1]庚-2-烯-6-酮,又称菊花烯酮、菊酮、2-蒎烯-7-酮,是一个有机化合物,为多种植物精油的成分。
| 菊油环酮 | |||
|---|---|---|---|
| |||
| 别名 | 菊花烯酮 2-蒎烯-7-酮 | ||
| 识别 | |||
| CAS号 | 473-06-3 | ||
| PubChem | 442463 | ||
| ChemSpider | 390901 | ||
| 性质 | |||
| 化学式 | C10H14O | ||
| 摩尔质量 | 150.22 g·mol−1 | ||
| 氣味 | 菊花樹脂香氣 | ||
| 密度 | 0.992 g/cm3 | ||
| 熔点 | 81-82 °C(354-355 K) | ||
| 沸点 | 104~106 °C(377~379 K)(36托压强下)[1] | ||
| 溶解性(水) | 0.11 g | ||
| 蒸氣壓 | 0.216毫米汞柱 | ||
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |||
历史
菊油环酮由大阪市立大學化学家野中啓明与小竹無二雄首次从杭白菊樹脂提取出来。1956年,野中啓明研究菊花香气里的化学成分,他从菊花萃取精油,发现精油含有少量的某种酮类化合物,该化合物沸点较高,分子式为C10H14O。1957年,野中啓明和小竹無二雄两人一同研究杭白菊樹脂。他们用醚类溶剂提取杭白菊樹脂的化学成分後,得到一种蜡状物质。他們再透过水蒸气蒸馏(压强为100托)分离出蜡状物质裡的挥发性成分。两人发现,冰片、乙酸冰片酯和一些酮类化合物构成了挥发性成分的50%。他们把已知的化学物质分离出去,剩下一个未知的酮类化合物,它的分子式为C10H14O,并带有菊花樹脂的香气。两人把这个化合物命名为“chrysanthenone”,其中“chrysanth-”来自菊花的学名“chrysanthemum”、“-en-”为烯烴命名的後綴、“-one”为酮类化合物命名的後綴。[2][3]
制备
天然来源
菊油环酮常见于以色列、西班牙、突尼西亚、阿尔及利亚、摩洛哥出产的植物精油。例如,菊油环酮化学型白草蒿的精油便以菊油环酮为主要成分,这个化学型很稀有,主要见于摩洛哥东北部、穆盧耶河上游一带。此外,多个菊属品种都含有菊油环酮。[4][5][6]
化学反应
外消旋作用
菊油环酮存在对映异构体,分别为左旋菊油环酮、右旋菊油环酮,前者可以进行外消旋作用来生成后者。[10][11]
加热至摄氏65至81度下,左旋菊油环酮分子受热开环,并发生外消旋作用,生成右旋菊油环酮。这个反应涉及3,7-二甲基辛-1,3,6-三烯-1-酮(一个烯酮)作为反应中间体。因此,如果把左旋菊油环酮与甲醇混合,并回流加热,左旋菊油环酮会进行外消旋,这时作为反应中间体的烯酮会与甲醇反应,产生酯;这样生成的酯有两种,它们的差异是碳碳双键处于不同位置。[10][12]
在輻照下,左旋菊油环酮迅速进行光可逆的光外消旋作用,生成右旋菊油环酮。这个反应同样涉及一个烯酮中间体。[11]
脱羰作用
持续輻照下,左旋菊油環酮除了发生光外消旋作用外,还会进行脱羰作用,生成2,4,4-三甲基双环[3.1.0]己-2-烯、2,6,6-三甲基双环[3.1.0]己-2-烯。如果把左旋菊油環酮样本用450瓦特水银灯照射20分钟,会以35%的收率生成一份混合物,该混合物由左旋菊油環酮(占33%)、右旋菊油環酮(占52%)、2,4,4-三甲基双环[3.1.0]己-2-烯(占2%)、2,6,6-三甲基双环[3.1.0]己-2-烯(占13%)所构成。[11]
重排反应
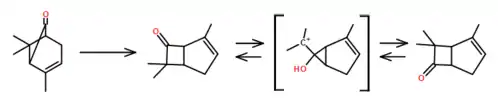
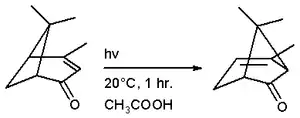
双环[3.1.1]庚酮类化合物可以经由重排反应生成双环[3.2.0]庚酮类化合物。因此,左旋菊油环酮能进行重排反应,生成(+)-4,7,7-三甲基双环[3.2.0]庚-3-烯-6-酮。进行这个反应的典型方法有:
- 把乙酸加入到左旋菊油环酮样本,加热至摄氏118度,维持一小时。这个方法的产率为38%。
- 把含有三氟化硼-乙醚络合物的1,2-二氯乙烷溶液加入到左旋菊油环酮样本,控溫于摄氏26度,维持30分钟。这个方法的产率为26%。
如果左旋菊油环酮持续置于酸性环境中,可进一步进行重排反应,生成(-)-2,7,7-三甲基双环[3.2.0]庚-2-烯-6-酮,产率为1%。这个反应属于可逆反应,涉及一个碳正离子中间体。[13]
异构化反应
在高温下,右旋菊油环酮发生异构化反应,生成同分异构体2,6,6-三甲基双环[3.2.0]庚-2-烯-7-酮。反應可能涉及3,7-二甲基辛-1,3,6-三烯-1-酮作為反應中間體,這個中間體生成后可能变回菊油环酮,也可能进行[2+2]光环化加成反应来生成同分异构体。[15]
与2,4-二硝基苯肼的反应
把2,4-二硝基苯肼、乙醇、浓硫酸、水加到菊油环酮后,静置一天,混合物里会出现形似树脂的沉澱物。这时候再把乙醇加进混合物裡,会逐渐生成晶体,经过柱色谱法分离后,可见这些晶体为红色和黄色。[17]
拜耳-维立格氧化反应
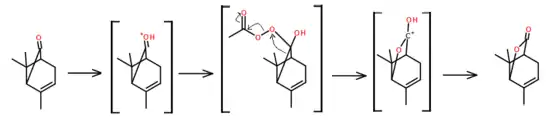
酮类化合物可以进行拜耳-维立格氧化反应以生成酯。因此,右旋菊油环酮能够通過这个反应,以醋酸和过氧化氢为氧化剂,氧化成4,8,8-三甲基-6-氧杂双环[3.2.1]辛-3-烯-7-酮。这个反应产物是一个具光学活性的内酯。[18]
生物活性
一篇发表于1993年的研究指出,根据引诱实验和林间引诱实验结果,山松甲虫对人工诱饵的反应不受菊油环酮影响;换句话说,在这些实验中,菊油环酮对山松甲虫没有吸引或排斥作用,没有显示出生物活性。[23]
一篇发表于2013年的研究分析了犹太蒿叶子、周边空气和土壤的挥发性有机化合物含量,发现菊油环酮在植物周边空气的浓度远高于它在叶子和土壤的浓度,可见菊油环酮是犹太蒿化感作用中的重要角色,能够抑制附近植物的發芽和长根。[24]
一篇发表于2018年的研究显示,植物精油抑制綠膿桿菌菌膜生长的能力与菊油环酮的浓度成反比例,而且菊油环酮可能促进菌膜形成。[25]
参考资料
引用
- Kotake & Nonaka 1957.
- 野中啓明 1956, p. 70.
- Kotake & Nonaka 1957, pp. 153, 154.
- Tilaoui et al. 2015.
- Neffati, Najjaa & Máthé 2017, pp. 98, 99.
- Akihiko et al. 1973, p. 1565.
- Erman 1967, pp. 3838, 3929.
- Jarchow-Choy, Koppisch & Fox 2014, pp. 1063, 1064, 1072.
- Kotake & Nonaka 1957, p. 154.
- Tidwell 2006, p. 160.
- Bushby et al. 2014, p. 1158.
- 朱玉娟, 何玲 & 李卫东 2017, p. 69.
- Butenschön et al. 2014, p. 239.
- Rodd et al. 1994, p. 373.
- Asfaw et al. 2001, p. 490.
- Kotake & Nonaka 1957, p. 157.
- Kotake & Nonaka 1957, p. 159.
- 宋志光 et al. 2005, pp. 2264, 2265.
- Arbuzov et al. 1972, pp. 1243, 1245.
- Meng 1999, p. 79.
- ApSimon 2009, p. 533.
- ApSimon 2009, p. 190.
- Kostyk, Borden & Gries 1993, pp. 1749, 1755.
- Friedjung et al. 2013.
- Artini et al. 2018, p. 11.
- Chang & Kim 2008, p. 126.
- Duke 2002, p. 250.
书籍
- Rodd, Ernest Harry; Coffey, Samuel; Ansell, M. F.; Sainsbury, Malcolm. 2. Elsevier. 1994. ISBN 9780444814838.
- Duke, James A. . CRC Press. 2002. ISBN 9781420040487.
- Tidwell, Thomas T. 2. 2006. ISBN 9780471767664.
- ApSimon, John. 4. 2009. ISBN 9780470129531.
- Bushby, R.J.; Eilbracht, Peter; Kimpe, Norbert de; Goldschmidt, Zeev. 4. Georg Thieme Verlag. 2014. ISBN 9783131819543.
- Butenschön, Holger; Chow, Hak-Fun; Fitjer, Lutz; Haufe, Günter. . Georg Thieme Verlag. 2014. ISBN 9783131819840.
- Neffati, Mohamed; Najjaa, Hanen; Máthé, Ákos. . Springer. 2017. ISBN 9789402411201.
期刊与论文
- 野中啓明. . 日本化学雑誌. 1956, 77 (12) [2018-04-04]. doi:10.1246/nikkashi1948.77.1818. (原始内容存档于2018-04-04).
- Kotake, Munio; Nonaka, Hiroaki. . European Journal of Organic Chemistry. 1957, 607 (1). doi:10.1002/jlac.19576070118.
- Erman, William F. . Journal of the American Chemical Society. 1967, 89 (15). doi:10.1021/ja00991a026.
- Arbuzov, B. A.; Vereshchagin, A. N.; Gubkina, N. I.; Salykova, I. M.; Vul'fson, S. G. . Bulletin of the Academy of Sciences of the USSR, Division of chemical science (Kluwer Academic Publishers-Plenum Publishers). 1972, 21 (6). ISSN 1573-9171. doi:10.1007/BF00854536.
- Akihiko, Matsuo; Yasuto, Ughio; Mitsuru, Nakayama; Shuichi, Hayashi. . Bulletin of the Chemical Society of Japan. 1973, 46 (5). doi:10.1246/bcsj.46.1565.
- Kostyk, B. C.; Borden, J. H.; Gries, G. . Journal of Chemical Ecology. 1993, 19 (8). doi:10.1007/BF00982305.
- Meng, Wei. (Ph.D.论文). 1999.
- Asfaw, Nigist; Storesund, Hans J; Skattebøl, Lars; Aasen, Arne J. . Phytochemistry. 2001, 58 (3). doi:10.1016/S0031-9422(01)00254-0.
- 宋志光; 李静; 刘庆文; 李叶芝; 黄化民. . 高等学校化学学报. 2005, 26 (12).
- Chang, Kyung-Mi; Kim, Gun-Hee. (PDF). Journal of Food Science and Nutrition. 2008, 13 (2) [2018-04-06]. doi:10.3746/jfn.2008.13.2.122. (原始内容存档 (PDF)于2018-04-06).
- Friedjung, Avital Yosef; Choudhary, Sikander Pal; Dudai, Nativ; Rachmilevitch, Shimon. . PLOS ONE. 2013, 8 (12). doi:10.1371/journal.pone.0081580.
- Jarchow-Choy, Sarah; Koppisch, Andrew; Fox, David. (PDF). Current Organic Chemistry. 2014, 18 (8) [2018-04-06]. doi:10.2174/1385272819666140501001101. (原始内容存档 (PDF)于2018-04-06).
- Tilaoui, Mounir; Ait Mouse, Hassan; Jaafari, Abdeslam; Zyad, Abdelmajid; Agarwal, Rajesh. . PLOS ONE. 2015, 10 (7). doi:10.1371/journal.pone.0131799.
- 朱玉娟; 何玲; 李卫东. . 中国科技论文在线精品论文. 2017, 10 (1).
- Artini, Marco; Patsilinakos, Alexandros; Papa, Rosanna; Božović, Mijat; Sabatino, Manuela; Stefania, Garzoli; Vrenna, Gianluca; Tilotta, Marco; Pepi, Federico; Ragno, Rino; Selan, Laura. . Molecules. 2018, 23 (2) [2018-04-05]. doi:10.3390/molecules23020482. (原始内容存档于2018-04-05).
-chrysanthenone.png.webp)
.png.webp)
.png.webp)