驱动蛋白
驱动蛋白(英語:)是一类蛋白质超级家族,属于分子马达的一种,其成员代表驱动蛋白-1()在1985年被发现。驱动蛋白是由单体组成的多聚体,其“头部”具有ATP酶活性[1],能通过水解ATP获得能量,改变构型,进行运动。它和动力蛋白一样,以微管构成的轨道进行滑行。与可以朝微管两极运动的动力蛋白有些不一样,一种驱动蛋白只能朝一个方向运动[2],如驱动蛋白-1可以沿着微管的+运动,而另一些驱动蛋白则沿着-极运动,在细胞内起运输作用,比如牵拉染色体,参与有丝分裂、减数分裂和细胞迁移过程。
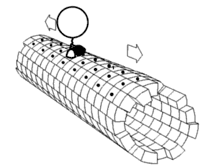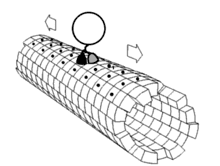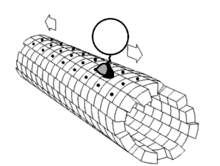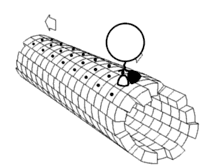
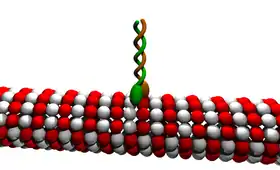
最近的研究又发现一批与驱动蛋白-1结构相关的蛋白质,它们一起构成驱动蛋白超级家族。这些蛋白质存在于绝大多数真核生物中。它们共有一保守的“马达”域,含有约350氨基酸残基,内有ATP结合位点和微管结合位点。即使在植物中,如拟南芥(Arabidopsis thaliana)中,目前也发现了A,B,C和D四种类驱动蛋白蛋白。
发现
20世纪80年代中期,人们虽然知道细胞内存在着分子马达,它们是ATP酶,靠着细胞骨架(具体来说是其中的微管)在细胞内执行者运输任务,但其具体结构仍未被确定。驱动蛋白的同僚——动力蛋白一直是该角色的主要候选者[3]。一直到了1985年,Lasek, RJ和Brady, ST则在nature上发表了《AMP-PNP可以易化轴浆中运输泡对微管的粘着》(Attachment of transported vesicles to microtubules in axoplasm is facilitated by AMP-PNP)一文,记述了他们的观察所得:ATP同型物AMP-PNP可以抑制轴突里的快速运输,同时会使细胞器与微管连合更紧密。这说明了AMP-PNP可促進微管——细胞器——马达分子复合体的形成。而这种马达蛋白质,很快就在同年被Vale RD, Reese TS等人确定了。它们在乌贼那巨型的神经轴突轴浆中发现了一种可溶的蛋白质,可以使微管在玻璃上,乳胶微球在微管上和轴浆细胞器在微管上移动。而且他们发现牛的脑部有着与之同源的蛋白质。这种蛋白质在ATP同型物——亚氨二磷酸盐(imidodiphosphate)的存在下,显示相当强的微管亲和力。他们还将它从微观上分离,与ATP混合放到凝胶过滤(gel filtration)柱上,该蛋白质在柱上移行,并被测重,得出60萬atom的分子量,11到12和6到7萬atom的多肽链。这些数据有别于以往动力蛋白和肌球蛋白的数据。因此试验人员认为,他们得到了一种新的分子马达,并将之命名为驱动蛋白[4]。而分子马达的大热门——动力蛋白存在的确凿实验证据则在两年后的1987年才发表。
酿酒酵母(Saccharomyces cerevisiae)的驱动蛋白基因序列最初是1992年由Beltran,C所发表。而在NCBI上的人体驱动蛋白马达域的mRNA和蛋白质序列则是由南京医科大学在2001年提供的[5]。接着,2002到2003年,富克葡萄孢盘菌(Botryotinia fuckeliana)、异旋孢腔菌(Cochliobolus heterostrophus)和玉米黑粉菌(Ustilago maydis)驱动蛋白马达域的序列也被查明。同时,科学家还在如黑猩猩(Pan troglodytes)体内,预测了蛋白质异形体1和2,它们和人类的驱动蛋白显示出98%的同源性,而各自演化成為相同蛋白質的期望值为0(就是指,假如两个蛋白质独立进化,是没有可能达到如此98%相似的程度的)。换句话说,它们是来自同一祖先。
结构
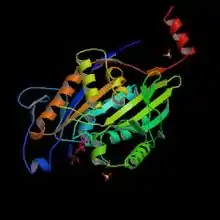
驱动蛋白是由单体组成的聚合体。两条包括催化活性的重链,而大部分驱动蛋白家族的成员重链都有一段α螺旋,两个单体的α螺旋因组成卷曲螺旋(coiled coil)而紧密结合。另外它们还有两条不具有催化活性的轻链。比如驱动蛋白-1是一alpha2-beta2的异四聚体,驱动蛋白-5则是同四聚体,驱动蛋白-2则是异三聚体。
驱动蛋白-1在高离子强度环境下会呈现其未折叠状态,沉降系数为9S。相反,它会在低离子浓度时折叠,沉降系数变为9S。折叠是重链的头部和尾部的相互间作用促成的。这个结论,是根据实验观察得出的。无需轻链的存在,单单是由重链组成的二聚体也会从5S的未折叠状态改变构象成为7S的折叠状态。细胞却要避免驱动蛋白的折叠,因为折叠状态的驱动蛋白并不能快速行进,而且对微管的亲和力也不高。
从扫描电子显微镜观察得出的结果,驱动蛋白1和驱动蛋白14(有被命为)虽然回响着不同的方向运动,但是它们头部与微观结合的结构却是相似的[6]。
驱动蛋白-1

驱动蛋白-1是第一种被发现的驱动蛋白,存在于目前已研究的所有多细胞生物即其所有细胞种类之中,并且可见于细胞生长的各个阶段。大部分的驱动蛋白-1都游离于胞质中,一些则会连接一些和胞膜相连的细胞器,如小泡,内质网,还有内质网与高尔基体之间的膜性结构。科学家将在试管中得到证实的抗驱动蛋白-1抗体注射入或者散布在细胞上,再观察其结果,可见微管依赖的溶酶体,高尔基体驱动的小泡,与胞膜连接的色素颗粒还有中间纤维的运输都受到抑制。在另一组实验中,科学家将反义寡核苷酸结合到驱动蛋白-1的mRNA上,抑制其翻译,发现轴突内各种蛋白质的顺行性运输(anterograde axonal transport)都受阻。加上其它数据,可以推测驱动蛋白-1会拉动细胞器,在微管上朝着其+极运动。
科罗拉多大学(University of Colorado)的比尔·萨斯通带领其实验室对黑腹果蝇的驱动蛋白-1或驱动蛋白重链(kinesin heavy chain,简称Khc)的致死性隐性突变进行了研究,并得出结论:驱动蛋白-1是轴突快速运输的一种马达。果蝇在死亡之前,患有进行性远端麻痹(progressive distal paralysis)。而且麻痹最严重的部位是后部体节的腹侧面。这样会造成其幼虫身体收缩的不对称,尾部会有节奏的往上翘并屈爬向前。这种表现型是神经系统因为轴突快速运输功能障碍而受损。在果蝇幼虫第二龄期(instar),体节神经轴突末端会与胞膜结合的细胞器共同形成膨大,这种堵塞应该是由失能的驱动蛋白,运输无力,货物被堆积积聚而造成的膨大会变得越来越大,这会引起遗传性神经接合,顺行性和逆行性(retrograde)快速运输都会受阻。驱动蛋白这种变异会在第三龄期因为降低离子通道活性,而造成动作电位散布受阻。因此实验人员认为,细胞器阻塞使得离子通道成分顺行性运输受阻。来自免疫细胞学方面的证据更是进一步指出,甚至是II型成束蛋白(Fasciclin II),突触结合蛋白(synaptotagmin)和突触融合蛋白(syntaxin)这些神经突触组成所需的蛋白质也一样会受阻。运动神经元末端营养不足。因此这些果蝇在第三龄期后侧体节轴突数量只有正常的1/5,前端的只有正常1/3。不但是突触的数量,就是连神经递质也会减少。又因为果蝇神经元胞体在头部,其支配尾部体节的轴突要比支配前端的长,所以驱动蛋白-1的失活会导致这种长短距不一的效果。变异果蝇的奇怪表现型也得到了解释[7]。
参考文献
- Beltran C, Kopecky J, Pan YC, Nelson H, Nelson N. . jbc.org. [2005-01-01].
- Dixit, R.; 等. . Scienceexpress. 2008. (原始内容存档于2013-05-03) (英语).
- George S. Bloom. . proweb.org. [2005-01-01]. (原始内容存档于2005-02-05).
- Vale RD, Reese TS, Sheetz MP. . .ncbi.nlm.nih.gov. [2005-01-01].
- Sha,J.H., Zhou,Z.M. and Li,J.M. . ncbi.nlm.nih.gov. [2005-01-01].
- David Hackney. . proweb.org. [2005-01-01]. (原始内容存档于2005-02-14).
- Bill Saxton. . proweb.org. [2005-01-01]. (原始内容存档于2004-12-14).
